Toluol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Toluol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H8 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit charakteristischem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 92,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,87 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
111 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (520 mg·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Brechungsindex |
1,4969[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Toluol (IUPAC) ist eine farblose, charakteristisch riechende, flüchtige Flüssigkeit, die in vielen ihrer Eigenschaften dem Benzol ähnelt. Toluol ist ein aromatischer Kohlenwasserstoff, häufig ersetzt es als Lösungsmittel das giftige Benzol. Es ist unter anderem auch im Benzin enthalten.
Etymologie
Als Henri Etienne Sainte-Claire Deville Toluol aus Tolubalsam gewann, hatte er für diesen Körper den Namen Benzoën angenommen, der bei den Balsamen, von denen er herkommt, an den fast generischen Charakter erinnert, den nämlich, Benzoesäure zu halten. Berzelius schlug dann in seinen Jahresberichten den Namen Toluin vor.[7] Die Abwandlung in Toluol taucht erstmals in einer Arbeit von Muspratt und Hoffmann auf,[8] die indessen – wohl irrtümlich – sich bezüglich des Namens auf die obige Stelle von Berzelius berufen.[9]
Geschichte
Toluol wurde erstmals von Pierre-Joseph Pelletier und Filip Neriusz Walter 1837 isoliert. Pelletier fand die Verbindung in dem Gas, das von der Rinde der See-Kiefer (damals Pinus maritima) emittiert wird. Pelletier nannte die Substanz Retinaphta, nach dem Kiefernharz.[10] 1841 wurde Toluol dann auch von Henri Etienne Sainte-Claire Deville durch trockene Destillation aus dem Tolubalsam gewonnen; hierauf beruht auch der heutige Name.[11][12] Charles Blachford Mansfield erfand ein Verfahren zur fraktionierten Destillation von Benzol aus Steinkohlenteer, das er sich 1848 patentieren ließ und er stellte Benzol und Toluol in größeren Mengen dar.[13] Durch Nitrierung von Toluol mittels Nitriersäure (Mischung aus Salpetersäure und Schwefelsäure) wurde 1863 durch den Chemiker Julius Wilbrand zum ersten Mal TNT hergestellt. Die Großproduktion von TNT wurde in Deutschland schließlich im Jahre 1901 aufgenommen; dieses Verfahren wird noch heute verwendet.
Vorkommen und Emissionen
Toluol kommt im Erdöl und in dem Leichtöl, das bei der Steinkohleteerdestillation anfällt, in kleineren Mengen vor. Da Toluol im Benzin enthalten ist wird es unter anderem im Kfz-Verkehr freigesetzt. Es entsteht in kleinen Mengen bei der unvollständigen Verbrennung von organischen Stoffen, wie zum Beispiel beim Rauchen. In den letzten Jahren ist ein Rückgang der Toluolemissionen zu verzeichnen. Das Jahresmittel beträgt zum Beispiel in Rheinland-Pfalz 30 µg/m3; je nach Ort kann es jedoch zu größeren Schwankungen dieses Wertes kommen. Hauptemissionsfaktor ist mit ca. 65 % der Kfz-Verkehr, 33 % sind auf den Gebrauch von Toluolprodukten und 2 % auf die Toluolherstellung zurückzuführen. Freigesetztes Toluol wird in der Erdatmosphäre, wie beim Benzol, nach mehreren Tagen durch Reaktionen mit Hydroxylradikalen (OH-Radikale) abgebaut.
Gewinnung und Darstellung
Eine direkte Gewinnung aus Erdöl oder durch Trockendestillation von Steinkohle ist – auf Basis der Rohölpreise von 2006 – noch nicht wirtschaftlich.
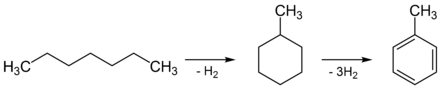
In der Industrie wird es hauptsächlich bei der Verarbeitung von Erdöl gewonnen, indem das (durch Cracken erzeugte) n-Heptan zu Methylcyclohexan reformiert und danach zu Toluol dehydriert wird. Diesen Vorgang nennt man auch Dehydrocyclisierung.
Während des Zweiten Weltkrieges kam es in Deutschland wegen des fehlenden Erdöls zu Engpässen bei der Toluolherstellung, weswegen es auch aus Benzol und Methanol mittels der Friedel-Crafts-Alkylierung hergestellt wurde.[14] Die Friedel-Crafts-Alkylierung hat limitierende Faktoren, die die Ausbeute und damit die wirtschaftliche Bedeutung erheblich senken: Alkylbenzole sind in der elektrophilen Substitution an Aromaten reaktiver als Benzol selbst; daher tendiert das gerade erst entstandene Alkylbenzol dazu, zu zwei- und mehrfach alkylierten Produkten zu reagieren. Die Ausbeute von Toluol wird geringer:

Aufgrund der geringen Kosten der Ausgangsstoffe werden immense Mengen davon kontinuierlich umgesetzt, das dabei entstehende Toluol durchgehend abgetrennt und der Gleichgewichtsreaktion somit entzogen. Weiterhin fällt Toluol als Nebenprodukt bei der Herstellung von Ethen und Propen an. Photochemisch ist es durch Isomerisierung von Cycloheptatrien zugänglich.
Die Weltproduktion von Toluol liegt zwischen fünf und zehn Millionen Tonnen jährlich.
Eigenschaften
Physikalische Eigenschaften
Toluol ist der einfachste Vertreter der Alkylbenzole. An der Luft verbrennt es nur unvollständig mit gelber, stark rußender Flamme. Die Flüssigkeit riecht charakteristisch, stechend angenehm (ähnlich wie Benzol) und hat eine Geruchsschwelle von 0,6–263 mg/m3. Toluol schmilzt bei −95 °C, siedet bei 111 °C und ist bei Normalbedingungen eine farblose, klare, wasserhelle Flüssigkeit, die stark lichtbrechend ist (Brechungsindex: 1,4969). In Wasser ist es fast unlöslich (0,47 g/l); mit Kohlenstoffdisulfid, Ethanol und Diethylether ist es in jedem Verhältnis mischbar. Auch in Chloroform, Aceton und den meisten weiteren organischen Lösungsmitteln ist Toluol gut löslich. Die Verbindung bildet mit einer Reihe von Lösungsmitteln azeotrop siedende Gemische. Die azeotropen Zusammensetzungen und Siedepunkte finden sich in der folgenden Tabelle. Keine Azeotrope werden mit n-Hexan, n-Heptan, n-Octan, Benzol, Ethylbenzol, Cyclohexanol, Chloroform, Tetrachlorkohlenstoff, Aceton, Methylethylketon, Diethylether, Ethylacetat, Dimethylformamid, Dimethylsulfoxid, Schwefelkohlenstoff und Phenol gebildet.[15]
| Azeotrope mit verschiedenen Lösungsmitteln[15] | ||||||||||||
| Lösungsmittel | Wasser | Methanol | Ethanol | 1-Propanol | 2-Propanol | 1-Butanol | iso-Butanol | sec-Butanol | ||||
| Gehalt Toluol | in Ma% | 80 | 31 | 32 | 51 | 31 | 68 | 55 | 45 | |||
| Siedepunkt | in °C | 85 | 64 | 77 | 93 | 81 | 106 | 101 | 95 | |||
| Lösungsmittel | Ethandiol | Methylglycol | Ethylglycol | 1,4-Dioxan | Acetonitril | Essigsäure | Pyridin | Methylisobutylketon | ||||
| Gehalt Toluol | in Ma% | 93 | 74 | 89 | 20 | 24 | 72 | 68 | 97 | |||
| Siedepunkt | in °C | 110 | 106 | 110 | 102 | 81 | 101 | 108 | 111 | |||
Die dynamische Viskosität beträgt 0,6 mPa·s, Toluol ist also dünnflüssiger als Wasser. Der Heizwert beträgt 40.940 kJ/kg.
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
12,0 kJ·mol−1[16] 50,1 kJ·mol−1[16] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0gas | −3910,9 kJ·mol−1[17] | |
| Wärmekapazität | cp | 157,09 J·mol−1·K−1 (25 °C)[18] 1,70 J·g−1·K−1 (25 °C)[18] 137,2 J·mol−1·K−1 (120 °C)[19] 1,49 J·g−1·K−1 (120 °C)[19] |
als Flüssigkeit als Gas |
| Kritische Temperatur | Tc | 591,75 K[20] | |
| Kritischer Druck | pc | 41,58 bar[20] | |
| Kritisches Volumen | Vc | 0,316 l·mol−1[20] | |
| Kritische Dichte | ρc | 3,17 mol·l−1[20] | |
| Azentrischer Faktor | ωc | 0,264[21] | |
| Schmelzenthalpie | ΔfH | 6,61 kJ·mol−1[22] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH0 ΔVH |
38,1 kJ·mol−1[23] 33,18 kJ·mol−1[23] |
am Normaldrucksiedepunkt |
Chemische Eigenschaften
Toluol ist bei Normalbedingungen stabil und relativ reaktionsträge. Es geht ähnliche Reaktionen ein wie Phenol und Benzol. Toluol greift viele Kunststoffe an und wird deswegen meist in Glas- oder Metallbehältern aufbewahrt. Durch Oxidation (zum Beispiel mit saurer Kaliumpermanganat-Lösung) kann Toluol über Benzylalkohol und Benzaldehyd zu Benzoesäure umgewandelt werden. Toluol geht vor allem radikalische Substitutionsreaktionen und elektrophile Substitutionsreaktionen ein. Nukleophile Substitutionsreaktionen sind seltener.
Insbesondere in der Hitze oder unter Bestrahlung mit Licht kann Toluol mit geeigneten Reaktionspartnern (beispielsweise Brom) radikalische Substitutionsreaktionen an der Methylgruppe eingehen (siehe SSS-Regel):

Da Toluol relativ reaktionsträge ist, laufen elektrophile Substitutionsreaktionen an ihm nur relativ langsam ab. In Gegenwart eines geeigneten Katalysators kann die Reaktionsgeschwindigkeit erheblich gesteigert werden (siehe KKK-Regel). Es entstehen bevorzugt para- und ortho-substituierte Produkte:

Toluol reagiert mit Salpetersäure zu 4-Nitrotoluol und Wasser, daneben entsteht auch das isomere 2-Nitrotoluol. Das eigentliche nitrierende Agens (NO2+) wird in Gegenwart von Schwefelsäure aus Salpetersäure gebildet:

Über mehrfache Nitrierung kann TNT (Trinitrotoluol) gewonnen werden.
Eine weitere, wichtige Reaktion ist die Oxidation von Toluol zu Benzoesäure.
Sicherheitstechnische Kenngrößen
Toluol bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 6 °C. Der Explosionsbereich liegt zwischen 1,1 Vol.‑% (42 g/m3) als untere Explosionsgrenze (UEG) und 7,8 Vol.‑% (300 g/m3) als obere Explosionsgrenze (OEG).[24] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von 3 °C sowie einen oberen Explosionspunkt von 40 °C. Die Sauerstoffgrenzkonzentration beträgt etwa 9,6 Vol.‑% (bei 100 °C).[24] Die Grenzspaltweite wurde mit 1,06 mm bestimmt.[24] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[24] Die Zündtemperatur beträgt 535 °C.[24] Der Stoff fällt somit in die Temperaturklasse T1. Die elektrische Leitfähigkeit ist mit 8·10−14 S·m−1 sehr gering, so dass beim Umgang elektrostatische Aufladungen auftreten können.[25]
Verwendung
Toluol wird als Lösungsmittel verwendet und kann dabei in vielen Fällen das gesundheitsschädlichere und giftige Benzol ersetzen. Es wird auch als Substrat zur Herstellung zahlreicher organischer Verbindungen wie z. B. Benzol, Sprengstoffe (TNT), Polyurethan-Vorprodukte (Diisocyanatotoluole), Benzoesäure, Phenol, ε-Caprolactam, Farbstoffe (Chlorierung, Sulfonierung von Toluol) eingesetzt. Es dient weiterhin als Beimischung in Motorkraftstoffen, als Verschnittmittel in Cellulosenitrat-Lacken, in wärmehärtenden Lacken auf der Basis von Harnstoff-, Melamin- oder Phenol-Formaldehyd-Harzen, in Alkydharzlacken, in Lacken auf der Basis von Chlorkautschuk, Polystyrol, Polyacrylaten oder Polyvinylacetat. Mischungen von Toluol mit Estern verwendet man zum Lösen von Vinylchlorid-Copolymerisaten und nachchloriertem Polyvinylchlorid.[11]
Bekannt ist auch die Verwendung in Permanentmarkern, die jedoch inzwischen meist toluol- und xylolfrei hergestellt werden.
Toluol kommt auch, je nach Messbereich, bei Thermometern als Füllflüssigkeit zum Einsatz.
Toxikologie
Toluol ist leichtentzündlich und gesundheitsschädlich. Toluol verursacht Nerven-, Nieren- und möglicherweise auch Leberschäden. Toluol kann vermutlich das Kind im Mutterleib schädigen. Die Inhalation von Toluoldämpfen kann zu unspezifischen Symptomen wie Müdigkeit, Unwohlsein, Empfindungsstörungen, Störungen der Bewegungskoordination und Bewusstseinsverlust führen. Bei regelmäßigem Kontakt kann es zu einer Toluolsucht kommen, die mit Heiterkeits- und Erregungsräuschen einhergeht. Toluoldämpfe haben eine narkotisierende Wirkung und reizen die Augen und Atmungsorgane schwer, allergische Reaktionen auf Toluol sind möglich. Toluol ist vermutlich ototoxisch im Menschen.[26] Toluol sollte an gut belüfteten Orten aufbewahrt werden.
Toluol selbst wirkt nicht erbgutverändernd, ist jedoch häufig mit Benzol verunreinigt. Die geringere Toxizität von Toluol gegenüber Benzol lässt sich mit seinem anderen Metabolismus erklären. Toluol wird im Gegensatz zum Benzol kaum durch Oxidation des Ringes, sondern hauptsächlich durch Oxidation der Seitenkette zur Benzoesäure metabolisiert. Der Grund dafür ist die hohe Selektivität des Monooxygenasesystems P450 für die Methylgruppe des Toluols. Aus diesem Grund entsteht kaum karzinogenes Epoxid wie im Falle des Benzols. Die geringen Mengen an Epoxid können durch Konjugation an Glutathion, spontane intramolekulare Umlagerung zum Phenol oder durch enzymatische Hydrolyse zum Diol abgebaut werden.

In Form von Benzoesäure und Hippursäure wird Toluol, neben kleinen Mengen o-Kresol, über den Harn ausgeschieden.

Risikobewertung
Toluol ist selbst in geringen Mengen wassergefährdend (WGK 3).[2] Es ist biologisch leicht abbaubar.[27]
Toluol darf in der EU seit 15. Juni 2007 nicht mehr als Stoff oder mit einem Anteil ab 0,1 Masseprozent als Bestandteil von Zubereitungen bzw. Gemischen in frei verkäuflichen Klebstoffen und Farbsprühdosen verwendet oder in Verkehr gebracht werden.[28] Toluol wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Toluol waren die Besorgnisse bezüglich der Einstufung als CMR-Substanz, Verbraucherverwendung, hoher (aggregierter) Tonnage, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung. Die Neubewertung fand ab 2012 statt und wurde von Finnland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[29][30]
Literatur
- Unterausschuss Wirkungsfragen des LAI: Bewertung von Toluol- und Xylol-Immissionen. Erich Schmidt Verlag, Berlin 1997, ISBN 3-503-04071-4.
- Jürgen Angerer: Prävention beruflich bedingter Gesundheitsschäden durch Benzol, Toluol, Xylole und Ethylbenzol. Gentner, Stuttgart 1983, ISBN 3-87247-311-5.
- A. Seeber, M. Blaszkewicz, P. Demes: Toluol in Tiefdruckereien. Abschlussbericht zu einem Forschungsprojekt. HVBG, Sankt Augustin 2002, ISBN 3-88383-623-0.
- Helmut Greim: Gesundheitsschädliche Arbeitsstoffe. Toxikologisch-arbeitsmedizinische Begründung von MAK-Werten. Toluol. VCH, Weinheim 1985, ISSN 0930-1984.
- Methylbenzol, Toluol. In: Beilsteins Handbuch der organischen Chemie. Band 5 (Syst. Nr. 466), H 280, S. EII 209.
Weblinks
- Verwendung und Gefahren: André Sepeur: Toluol. In: umweltlexikon-online.de. 22. Februar 2012, abgerufen am 27. Dezember 2014.
- BAUA: Begründung für Bewertung von Stoffeigenschaften: Toluol (PDF; 151 kB), 24. Mai 2002
Einzelnachweise
- ↑ Eintrag zu TOLUENE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Oktober 2021.
- ↑ a b c d e f g h i j k l m n Eintrag zu Toluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-58.
- ↑ Heinz G. O. Becker, Werner Berger, Günter Domschke: Organikum. 22. Auflage. Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3, S. 732.
- ↑ Eintrag zu Toluene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 108-88-3 bzw. Toluol), abgerufen am 2. November 2015.
- ↑ J. Berzelius: Jahresbericht über die Fortschritte der Chemie und Mineralogie. 22, Lauppsche Buchhandlung, Tübingen 1843, S. 354, online auf babel.hathitrust.org, abgerufen am 15. Januar 2017.
- ↑ Aug. Wilh. Hofmann: Ueber eine sichere Reaction auf Benzol. In: Liebigs Ann Chem, 55, 1845, S. 200–205, doi:10.1002/jlac.18450550205.
- ↑ Christian Wiegand: Entstehung und Deutung wichtiger organischer Trivialnamen. I. Kohlenwasserstoffe der Benzolreihe. In: Angewandte Chemie. 60 (4), 1948, S. 109–111, doi:10.1002/ange.19480600407.
- ↑ H. Limpricht: Lehrbuch der organischen Chemie. Band 2, C. A. Schwetske & Sohn, 1862, S. 791.
- ↑ a b Eintrag zu Toluol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. März 2017.
- ↑ Richard L. Myers: The 100 Most Important Chemical Compounds. Greenwood Press, 2007, ISBN 978-0-313-33758-1, S. 283.
- ↑ Lance Day, Ian McNeil: Biographical Dictionary of the History of Technology. Routledge, 2002, ISBN 978-1-134-65019-4, S. 801 (books.google.com).
- ↑ Houben-Weyl: Arene und Arine, 4. Auflage, Thieme, Stuttgart, 1981, S. 194. Eingeschränkte Vorschau in der Google-Buchsuche
- ↑ a b I. M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 40–42.
- ↑ a b M. V. Roux, M. Temprado, J. S. Chickos, Y. Nagano: Critically Evaluated Thermochemical Properties of Polycyclic Aromatic Hydrocarbons. In: J. Phys. Chem. Ref. Data. 37, 2008, S. 1855–1996.
- ↑ J. D. Cox, G. Pilcher: Thermochemistry of Organic and Organometallic Compounds. Academic Press, New York 1970, ISBN 0-12-194350-X.
- ↑ a b J.-P. E. Grolier, G. Roux-Desgranges, M. Berkane, E. Jimenez, E. Wilhelm: Heat capacities and densities of mixtures of very polar substances 2. Mixtures containing N,N-dimethylformamide. In: J. Chem. Thermodyn. 25, 1993, S. 41–50.
- ↑ a b D. W. Scott: Toluene: thermodynamic properties, molecular vibrations, and internal rotation. In: J. Phys. Chem. 66, 1962, S. 911–914.
- ↑ a b c d C Tsonopoulos; Ambrose, D.: Vapor-Liquid Critical Properties of Elements and Compounds. 3. Aromatic Hydrocarbons. In: J. Chem. Eng. Data. 40, 1995, S. 547–558. doi:10.1021/je00019a002
- ↑ Carl L. Yaws, Prasad K. Narasimhan: Thermophysical Properties of Chemicals and Hydrocarbons - Chapter 1: Critical Properties and Acentric Factor, Organic Compounds. 1. Auflage. Elsevier 2008, ISBN 978-0-8155-1596-8, S. 31. doi:10.1016/B978-081551596-8.50006-7
- ↑ E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. In: J. Phys. Chem. Ref. Data. 25, 1, 1996, doi:10.1063/1.555985.
- ↑ a b V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- ↑ a b c d e E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6.
- ↑ P. Hoet, D. Lison: Ototoxicity of toluene and styrene: state of current knowledge. In: Crit Rev Toxicol. Band 38, Heft 2, 2008, S. 127–170. doi:10.1080/10408440701845443. PMID 18259983.
- ↑ EG-SICHERHEITSDATENBLATT: TOLUOL (PDF). SCS, 1. März 2005.
- ↑ Art. 67 der Verordnung (EG) Nr. 1907/2006 vom 18. Dezember 2006. Abl. L 136, 29.05.2007 (PDF) mit Anhang XVII, Eintrag 48.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Report und Conclusion Document.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Toluene, abgerufen am 26. März 2019.


