Bariumbromat
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
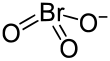
| |||||||
| Allgemeines | |||||||
| Name | Bariumbromat | ||||||
| Summenformel | Ba(BrO3)2 | ||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | |||||||
| Aggregatzustand |
fest | ||||||
| Dichte | |||||||
| Schmelzpunkt | |||||||
| Löslichkeit | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Bariumbromat ist das Bariumsalz der Bromsäure mit der chemischen Zusammensetzung Ba(BrO3)2.
Herstellung
Bariumbromat kann durch Kochen einer wässrigen Lösung von Bariumchlorid oder Bariumacetat mit Kaliumbromat hergestellt werden.[3][4]
Eigenschaften
Bariumbromat kristallisiert zu einem weißem Salz im monoklinen Kristallsystem in der Raumgruppe C2/c mit den Gitterparametern a = 1332 pm, b = 790 pm, c = 858 pm und ß = 134,2° sowie vier Formeleinheiten in der Elementarzelle.[5] Die Löslichkeit in Wasser nimmt mit steigender Temperatur zu: in 1 Liter Wasser lösen sich bei 0 °C 2.86 g, bei 25 °C 7.88 g und bei 99.65 °C 53.9 g Bariumbromat.[2] Bariumbromat tritt üblicherweise als Monohydrat Ba(BrO3)2 · H2O auf, das erst bei hoher Temperatur sein Kristallwasser abgibt.[4] Beim Erhitzen zerfällt Bariumbromat in Bariumbromid und Sauerstoff.[3]
Verwendung
Bariumbromat wird als Oxidationsmittel und als Korrosionsinhibitor verwendet.[2]
Einzelnachweise
- ↑ a b c Datenblatt Bariumbromat bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ a b c d e f Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 47 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Leopold Gmelin, K. List: Handbuch der anorganischen Chemie, Band 2, 1853, S. 146. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ a b R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 270.Volltext
- ↑ H. D. Lutz, E. Alici, T. Kellersohn, P. Kuske: Zur Polymorphie des Ba(BrO3)2 und Sr(IO3)2, Kristallstruktur, röntgenographische, schwingungsspektroskopische und thermoanalytische Untersuchungen. In Zeitschrift für Naturforschung, Teil B, Nr. 45, 1990, S. 587–592.


