Piperiton
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
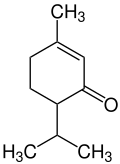
| |||||||||||||||||||
| Vereinfachte Struktur ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Piperiton | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H16O | ||||||||||||||||||
| Kurzbeschreibung |
gelbliche bis gelbe klare Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 152,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,94 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
235 °C[1] | ||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (2,48 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,48 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Piperiton ist ein Terpenoid beziehungsweise monocyclisches Monoterpen, setzt sich also aus zwei Einheiten Isopren zusammen.
Vorkommen

Piperiton kommt in vielen ätherischen Ölen vor, beispielsweise bei über dreißig Arten der Gattung Eucalyptus. Hohe Anteile finden sich bei einigen Arten von Eucalyptus und Mentha.[2] In der Gattung Eucalyptus kommen die größten Mengen in Eucalyptus dives vor.[3] Beide Enantiomere kommen natürlich vor. In Eucalyptus-Arten kommt (−)-Piperiton vor, in der Ackerminze (+)-Piperiton, in einigen Pflanzen auch racemisches Piperiton.[2]
Eigenschaften
Piperiton ist eine farblose Flüssigkeit mit einem deutlichen Geruch nach Pfefferminze.[3]
Herstellung
Piperiton kann aus Isopropylacetessigester und Methylvinylketon hergestellt werden.[4]
Reaktionen
Aus Piperiton können Menthol und Thymol hergestellt werden.[4] Die Reduktion zu Menthol gelingt mit Wasserstoff an einem Nickel-Katalysator. Die Oxidation zu Thymol gelingt mittels Eisen(III)-chlorid und Essigsäure. Es bildet außerdem Addukte mit Benzaldehyd und mit Hydroxylamin (ein Oxim), die früher hilfreich waren, um die Verbindung über den Schmelzpunkt der Derivate zu identifizieren.[3] Unter Einfluss von Licht geht Piperiton eine Photodimerisierung ein, bei der eine polycyclische Verbindung mit einem Cyclobutanring ausgebildet wird.[5]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu (R)-(-)-Piperitone, >94.0% bei TCI Europe, abgerufen am 14. Juli 2024.
- ↑ a b Uzi Ravid, Eli Putievsky, Irena Katzir: Enantiomeric distribution of piperitone in essential oils of some mentha spp., calamintha incána (sm.) heldr. and artemisia judaica L. In: Flavour and Fragrance Journal. Band 9, Nr. 2, März 1994, S. 85–87, doi:10.1002/ffj.2730090210.
- ↑ a b c John Read, Henry George Smith: LXXXVII.—Piperitone. Part I. The occurrence, isolation, and characterisation of piperitone. In: J. Chem. Soc., Trans. Band 119, Nr. 0, 1921, S. 779–789, doi:10.1039/CT9211900779.
- ↑ a b Fritz Eiden: Carl Hagemann ...ein Mensch von großer Güte, ein richtiger Chemiker... In: Chemie in unserer Zeit. Band 41, Nr. 4, August 2007, S. 316–323, doi:10.1002/ciuz.200700411.
- ↑ H. Ziffer, N.E. Sharpless, R.O. Kan: Photodimers of piperitone. In: Tetrahedron. Band 22, Nr. 9, Januar 1966, S. 3011–3020, doi:10.1016/S0040-4020(01)82280-8.
