Benzaldehído
| Benzaldehído | ||
|---|---|---|
 | ||
| Archivo:Benzaldehyde-3D-vdW.png y Benzaldehyde-3D-balls.png | ||
| Nombre IUPAC | ||
| Benzaldehído | ||
| General | ||
| Fórmula semidesarrollada | C6H5CHO | |
| Fórmula estructural |
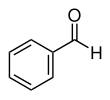 | |
| Fórmula molecular | C7H6O | |
| Identificadores | ||
| Número CAS | 100-52-7[1] | |
| ChEBI | 17169 | |
| ChEMBL | CHEMBL15972 | |
| ChemSpider | 235 | |
| PubChem | 240 | |
| UNII | TA269SD04T | |
| KEGG | C00193 D02314, C00193 | |
| Propiedades físicas | ||
| Apariencia | Líquido incoloro con olor a almendras | |
| Densidad | 1041,5 kg/m³; 1,0415 g/cm³ | |
| Masa molar | 106 g/mol | |
| Punto de fusión | −26 °C (247 K) | |
| Punto de ebullición | 178,1 °C (451 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
todos los del cecyteg estan inventigando esto "2-.A" :P El benzaldehído (C6H5CHO) es un compuesto químico que consiste en un anillo de benceno con un sustituyente aldehído. Es el representante más simple de los aldehídos aromáticos y uno de los miembros industrialmente más usados de esta familia de compuestos. A temperatura ambiente, es un líquido incoloro, con un olor a almendras agradable y característico: el benzaldehído es un componente importante de la esencia de almendras, de ahí su olor típico. Es un componente primario del aceite de extracto de almendras amargas, y puede ser extraído de un número de otras fuentes naturales en las que está presente, como los albaricoques, cerezas, y hojas de laurel, semillas de duraznos y como amigdalina, combinada con un glicósido, en ciertas nueces y semillas. Actualmente el benzaldehído se fabrica principalmente a partir de tolueno por una diversidad de procesos diferentes.
Producción
El benzaldehído puede ser obtenido por varios procesos. Actualmente, la cloración en fase líquida o la oxidación del tolueno están entre los procesos más usados. También hay un número de aplicaciones discontinuadas, tales como la oxidación parcial del alcohol bencílico, tratamiento con álcali del cloruro de benzal y la reacción entre el benceno y el monóxido de carbono.
Reacciones
Al oxidarse, el benzaldehído se convierte en el ácido benzoico, que es inodoro. El alcohol bencílico puede formarse a partir de benzaldehído por medio de la hidrogenación, o tratando el compuesto con hidróxido de potasio alcohólico, con lo que sufre una oxidación y reducción simultánea que resulta en la producción de benzoato de potasio y alcohol bencílico, esta es la (reacción de Cannizzaro): una molécula del aldehído es reducida al alcohol correspondiente, y otra molécula es oxidada simultáneamente a la sal del ácido carboxílico. La velocidad de esta reacción depende de los sustituyentes presentes en el anillo aromático.
La reacción del benzaldehído con acetato de sodio anhidro y anhídrido acético produce ácido cinámico, por un mecanismo de condensación aldólica conocido como reacción de Knoevenagel; mientras que el cianuro de potasio alcohólico puede ser usado para catalizar la condensación de benzaldehído a benzoína.
Usos
Aunque se emplea comúnmente como un saborizante alimentario comercial (sabor de almendras) o solvente industrial, el benzaldehído se usa principalmente en la síntesis de otros compuestos orgánicos, que van desde fármacos hasta aditivos de plásticos. Es también un intermediario importante para el procesamiento de perfume y compuestos saborizantes, y en la preparación de ciertos colorantes de anilina.
La síntesis del ácido mandélico empieza en el benzaldehído:
Primero, se agrega ácido cianhídrico al benzaldehído y el nitrilo de ácido mandélico resultante es subsecuentemente hidrolizado a una mezcla racémica de ácido mandélico.
Los glaciologistas LaChapelle y Stillman reportaron en 1966 que el benzaldehído y el N-heptaldehído inhiben la recristalización de la nieve, y en consecuencia la formación de depósitos de hielo profundos. Este tratamiento podría prevenir las avalanchas causadas por capas de hielo profundas e inestables. Sin embargo, los químicos no tienen amplio uso porque ocasionan daño a la vegetación y contaminan las fuentes de agua.
Biología
Los corazones de las almendras, albaricoques, manzanas y cerezas contienen cantidades significativas de amigdalina. Este glicósido se rompe bajo catálisis enzimática en benzaldehído, cianuro de hidrógeno y dos moléculas de glucosa.
Punto de fusión: -26 °C
Punto de ebullición: 178 °C
Solubilidad 0.3g/100g agua
Densidad relativa: 1.05g a 20 °C
Masa molecular 106.13 g/mol
Referencias
Enlaces externos
- International Chemical Safety Card 0102
- European Chemicals Bureau
- Benzaldehyde description at ChemicalLand21.com
 Wikimedia Commons alberga una categoría multimedia sobre Benzaldehído.
Wikimedia Commons alberga una categoría multimedia sobre Benzaldehído.

