Depside
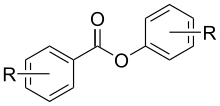

Les depsides (du grec ancien δέψω/dépsô, tanner) sont des produits de condensation de deux ou plusieurs acides hydroxycarboxyliques aromatiques monocycliques, dans lesquels le groupe carboxyle d'un acide est estérifié avec un groupe hydroxyle phénolique de l'autre. Dans le cas de deux molécules condensées, on parlera de didepside, pour trois de tridepside, etc.
Occurrence
[modifier | modifier le code]Les depsides se trouvent principalement dans les lichens[1], par exemple dans les Lecanoromycetes tels que la mousse de chêne (Evernia prunastri), Lecanora conizaeoides, les Arthoniaceae tels que Cryptothecia rubrocincta (en) (acide gyrophorique), ou encore les Cladonia (acide mérochlorophaéique)[2]. Ils sont également présents dans nombre de végétaux, par exemple sous la forme de tanins, notamment dans les espèces Ericaceae, Lamiaceae, Papaveraceae et Myrtaceae[3],[4],[5],[6]. On en trouve par exemple dans la sarriette (acide digallique), le romarin (acide romarinique (en), largement répandu dans les plantes) ou dans le café (acide chlorogénique, également présent dans un certain nombre de plantes).
-
Mousse de chêne (Evernia prunastri).
-
Grains de café légèrement torréfiés.
Métabolisme
[modifier | modifier le code]Les depsidases sont des enzymes capables de rompre les liaisons depside. Un exemple de ce type d'enzyme est la tannase[7].
Propriétés
[modifier | modifier le code]Certain depsides ont une activité antibiotique, antioxydante, et antiproliférative in vitro[6],[8],[9],[10]. Comme inhibiteurs de la biosynthèse de la prostaglandine et du leucotriène B4, certains depsides on une activité anti-inflammatoire in vitro[11],[12],[13],[14]. Certains depsides ont été décrits comme anti-VIH[15].
Les depsides ont une activité molluscicide sur les escargots d'eau douce. À des concentrations de 10−3 mol/l, ils inhibent la croissance des plantes.
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Depside » (voir la liste des auteurs) et « Depside » (voir la liste des auteurs).
- (de) Wolfgang Legrum, Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner, (ISBN 978-3-8348-1245-2), p. 140–141
- Shoji Shibata et Hsüch-Ching Chiang, « The structures of cryptochlorophaeic acid and merochlorophaeic acid », Phytochemistry, vol. 4, , p. 133–139 (DOI 10.1016/S0031-9422(00)86155-5)
- Ono M, Masuoka C, Koto M, Tateishi M, Komatsu H, Kobayashi H, Igoshi K, Ito Y, Okawa M, Nohara T, « Antioxidant ortho-benzoyloxyphenyl acetic acid ester, vaccihein A, from the fruit of rabbiteye blueberry (Vaccinium ashei) », Chem. Pharm. Bull., vol. 50, no 10, , p. 1416–7 (PMID 12372879, DOI 10.1248/cpb.50.1416)
- Zgórka G, Głowniak K, « Variation of free phenolic acids in medicinal plants belonging to the Lamiaceae family », J Pharm Biomed Anal, vol. 26, no 1, , p. 79–87 (PMID 11451645, DOI 10.1016/S0731-7085(01)00354-5)
- Hillenbrand M, Zapp J, Becker H, « Depsides from the petals of Papaver rhoeas », Planta Med., vol. 70, no 4, , p. 380–2 (PMID 15095160, DOI 10.1055/s-2004-818956)
- Reynertson KA, Wallace AM, Adachi S, Gil RR, Yang H, Basile MJ, D'Armiento J, Weinstein IB, Kennelly EJ, « Bioactive depsides and anthocyanins from jaboticaba (Myrciaria cauliflora) », J. Nat. Prod., vol. 69, no 8, , p. 1228–30 (PMID 16933884, DOI 10.1021/np0600999)
- Haslam E, Stangroom JE, « The esterase and depsidase activities of tannase », Biochem. J., vol. 99, no 1, , p. 28–31 (PMID 5965343, PMCID 1264952, DOI 10.1042/bj0990028)
- Kumar KC, Müller K, « Lichen metabolites. 2. Antiproliferative and cytotoxic activity of gyrophoric, usnic, and diffractaic acid on human keratinocyte growth », J. Nat. Prod., vol. 62, no 6, , p. 821–3 (PMID 10395495, DOI 10.1021/np980378z)
- Neamati N, Hong H, Mazumder A, Wang S, Sunder S, Nicklaus MC, Milne GW, Proksa B, Pommier Y, « Depsides and depsidones as inhibitors of HIV-1 integrase: discovery of novel inhibitors through 3D database searching », J. Med. Chem., vol. 40, no 6, , p. 942–51 (PMID 9083483, DOI 10.1021/jm960759e)
- Nielsen J, Nielsen PH, Frisvad JC, « Fungl depside, guisinol, from a marine derived strain of Emericella unguis », Phytochemistry, vol. 50, no 2, , p. 263–265 (DOI 10.1016/s0031-9422(98)00517-2)
- Gerrard JM, Peterson DA, « Structure of the active site of prostaglandin synthase from studies of depsides: an alternate view », Prostaglandins Leukot Med, vol. 13, no 2, , p. 139–42 (PMID 6425861, DOI 10.1016/0262-1746(84)90003-9)
- Sankawa U, Shibuya M, Ebizuka Y, Noguchi H, Kinoshita T, Iitaka Y, Endo A, Kitahara N, « Depside as potent inhibitor of prostaglandin biosynthesis: a new active site model for fatty acid cyclooxygenase », Prostaglandins, vol. 24, no 1, , p. 21–34 (PMID 6812170, DOI 10.1016/0090-6980(82)90174-5)
- Kumar KC, Müller K, « Lichen metabolites. 1. Inhibitory action against leukotriene B4 biosynthesis by a non-redox mechanism », J. Nat. Prod., vol. 62, no 6, , p. 817–20 (PMID 10395494, DOI 10.1021/np9803777)
- ((Kumar KCS)), Müller K, « Depsides as non-redox inhibitors of leukotriene B4 biosynthesis and HaCaT cell growth, 2. Novel analogues of obtusatic acid », Eur J Med Chem, vol. 35, no 4, , p. 405–11 (PMID 10858601, DOI 10.1016/S0223-5234(00)00132-X)
- Nouri Neamati, Huixiao Hong, Abhijit Mazumder, Shaomeng Wang, Sanjay Sunder, Marc C. Nicklaus, George W. A. Milne, Bohumil Proksa et Yves Pommier, « Depsides and Depsidones as Inhibitors of HIV-1 Integrase: Discovery of Novel Inhibitors through 3D Database Searching† », Journal of Medicinal Chemistry, vol. 40, no 6, , p. 942–951 (ISSN 0022-2623, PMID 9083483, DOI 10.1021/jm960759e)
Voir aussi
[modifier | modifier le code]- Depsidone
- Depsipeptide
- Acide gallique
- Salsalate, homodimère formé par auto-condensation de l'acide salicylique.


