Acido gallico
| Acido gallico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
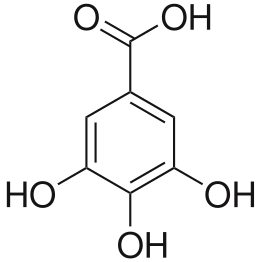
| acido 3,4,5-triidrossibenzoico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C7H6O5 |
| Massa molecolare (u) | 170,12 |
| Aspetto | bianco, giallo chiaro |
| Numero CAS | |
| Numero EINECS | 205-749-9 |
| PubChem | 370 |
| SMILES | C1=C(C=C(C(=C1O)O)O)C(=O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,7 |
| Costante di dissociazione acida (pKa) a 298 K | 4,4 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 315 - 319 - 335 |
| Consigli P | 261 - 305+351+338 [1] |
L'acido gallico o acido triidrossibenzoico è un acido organico contenuto in molti prodotti di origine vegetale. La formula chimica è C6H2(OH)3COOH.
Tra i fenoli di origine naturale rientra nella categoria degli acidi fenolici; ha azione antiossidante.
Il suo nome ha origine dalle galle, escrescenze che si formano sulle foglie o sui rami dei vegetali, dovute alla parassitosi di funghi, batteri, insetti o acari.
Biochimica
L'acido gallico è prodotto dalla pianta per combattere la proliferazione cellulare. È comune nelle specie vegetali legnose, presente in forma solubile come estere dell'acido chinico o legato a glucosio nei gallotannini. Oltre a trovarsi nelle foglie e nelle radici di alcune piante si trova anche nei semi e nei frutti come le olive, ed è per questo uno dei polifenoli contenuti nell'olio d'oliva. Si trova anche in more, lamponi, fragole e mango.
Usi
In campo medico, l'acido gallico è un potente antiemorragico ed è utilizzato nei casi di menorragia.
Alcuni suoi esteri (etilico, propilico, ottilico, ecc.) sono ampiamente utilizzati come conservanti alimentari ad azione antiossidante.
L'acido gallico trovò applicazione anche in ambito filologico: Angelo Mai lo utilizzava per rinvenire la scrittura inferiore dei palinsesti; si deve proprio all'utilizzo del mezzo chimico il grandioso successo nelle scoperte del filologo.[2]
L'acido gallico, inoltre, viene utilizzato per la produzione di inchiostri ferrogallici. L'acido gallico, se aggiunto ad una soluzione di sali di ferro, complessa gli ioni ferrosi (Fe2+), o ferrici (Fe3+) che siano, assumendo così una colorazione di nero intenso. A contatto con la carta, questo tipo di inchiostro penetra nelle fibre di cellulosa, rendendo indelebile ciò che vi viene scritto.
Altra applicazione è quella di inchiostri segreti: scrivendo con una soluzione acquosa di acido gallico, le scritte risultano invisibili; applicando una soluzione contenente ioni ferro in un secondo momento, la scritta diventa nera e leggibile.
Note
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su acido gallico
Wikimedia Commons contiene immagini o altri file su acido gallico
Collegamenti esterni
- pubblicazione del CNR, su fi.cnr.it. URL consultato il 29 giugno 2019 (archiviato dall'url originale il 17 agosto 2011).
- (EN) utilizzi in erboristeria, su henriettesherbal.com.
| Controllo di autorità | LCCN (EN) sh85052839 · GND (DE) 4155894-7 · J9U (EN, HE) 987007558077605171 |
|---|