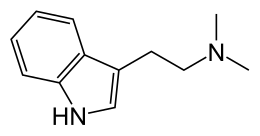
Dimetiltriptammina
| Dimetiltriptammina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 2-(1H-indol-3-il)-N,N-dimetiletanammina | |
| Nomi alternativi | |
| DMT N,N-dimetiltriptamina 3-[2-(dimetilammino)etil]indolo | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C12H16N2 |
| Massa molecolare (u) | 188,2718 |
| Aspetto | solido cristallino o ceroso di colore rosato, arancio o giallo |
| Numero CAS | |
| Numero EINECS | 200-508-4 |
| PubChem | 6089 |
| DrugBank | DBDB01488 |
| SMILES | CN(C)CCC1=CNC2=CC=CC=C21 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,099 |
| Temperatura di fusione | 49 °C (322,15 K) 74 °C (347,15 K) (strutture cristalline differenti) |
| Indicazioni di sicurezza | |
La N,N-dimetiltriptammina (N,N-DMT o DMT) è una triptammina psichedelica endogena, presente in molte piante e nel fluido cerebrospinale degli esseri umani, sintetizzata per la prima volta nel 1931 dal chimico Richard Manske.[1][2]

La DMT è presente in alcune varietà di mimosa, acacia, Anadenanthera, Virola, Desmodium, graminacee del genere Phalaris e molte altre piante e funghi. L'estrazione è possibile con alcuni solventi quali alcool, gasolio, esano oppure per distillazione. Nel bacino amazzonico alcuni popoli tribali hanno una tradizione di uso di piante contenenti DMT (utilizzando la linfa degli alberi Virola, parente della noce moscata, o i semi macinati e tostati di Anadenanthera peregrina, un enorme albero della famiglia delle Leguminose).
Strutturalmente la DMT è analoga al neurotrasmettitore serotonina, all'ormone melatonina e ad altre triptammine psicoattive come psilocibina, psilocina, NB-DMT e bufotenina, avendo rispettivamente formula chimica 4-fosforilossi-N,N-dimetil-triptammina (4-PO-DMT), 4-idrossi-N,N-dimetiltriptammina (4-HO-DMT) e 5-idrossi-N,N-dimetiltriptammina (5-HO-DMT) e ha un effetto quasi del tutto simile a queste, anche se differente per intensità.
Secondo Rick Strassman, medico specializzato in psichiatria che condusse numerose ricerche sulla DMT, la ghiandola pineale situata nell'encefalo è in grado di produrre più o meno blande quantità di DMT[3][4], specialmente intorno alle ore 3, 4 del mattino, durante la fase REM dei sogni.[5]
Neuroni di tipo D vengono accreditati per i ligandi con la molecola del DMT, 5HT-1 e 5HT-2 con precursori simili nel triptofano.[6]
Storia
L'uso di piante contenenti dimetiltriptammina, specialmente fra i popoli indigeni del Brasile e alcune tribù del sud America, è una pratica antichissima, spesso riservata agli sciamani che la utilizzavano nei rituali per entrare in contatto con gli "spiriti" o in pratiche di medicina[7][8][9]. La prima testimonianza registrata dell'uso di un preparato a base di DMT si ha da un frate impiegato nella seconda spedizione di Colombo nelle Americhe. Nel 1496, sull'isola di Hispaniola, osservò gli indiani Taino inalare una potente polvere enteogena chiamata 'kohhobba', "così forte che chi la assumeva perdeva coscienza".
Dal 1931 era nota come un prodotto di laboratorio dopo che venne sintetizzata per la prima volta dal chimico canadese Richard Manske. La sua scoperta come prodotto naturale è da attribuirsi al chimico e microbiologo brasiliano Oswaldo Gonçalves de Lima (1908-1989) che, nel 1946, la isolò dalla corteccia della radice di Mimosa tenuiflora. Dal 1955 la DMT è stata trovata in almeno 50 specie di piante appartenenti a 10 famiglie, e in almeno 4 specie di animali, tra cui una gorgonia, e 3 specie di mammiferi[10].
Nel 1957, oltre un quarto di secolo dopo la sua sintesi iniziale, il farmacologo Stephen Szara ha stabilito che la DMT causa effetti enteogeni in soggetti umani quando iniettato per via intramuscolare: "Entro cinque minuti dall'iniezione di 50-60 mg della sostanza, i soggetti sentono l'insorgenza dello stato alterato di percezioni. L'effetto di picco si verifica all'interno di un quarto d'ora. Questa fase è stata caratterizzata da allucinazioni visive, sia con gli occhi aperti o chiusi. Gli effetti tendono a diminuire fino a svanire totalmente entro 30 minuti/un'ora."
In epoca recente, con la riscoperta degli psichedelici in medicina[11], sono ripartiti studi volti a stabilire il potenziale terapeutico del DMT, in particolare nella forma tradizionale nota come ayahuasca, contro la depressione e la dipendenza da droghe pesanti[12].
Biosintesi

La dimetiltriptammina è un indolo-alcaloide proveniente dal percorso shikimico. È un derivato del triptofano con due gruppi metili aggiunti all'atomo ammina di azoto (N). La sua biosintesi è relativamente semplice, illustrata nello schema accanto. L'amminoacido triptofano nelle piante è un prodotto endogeno, mentre negli animali proviene dalla dieta e si trova abbondante nel cioccolato, nell'avena, nelle banane, nei datteri, nelle arachidi, nel latte e nei latticini.
La sintesi comincia con la decarbossilazione del triptofano da parte di un enzima amminoacido-aromatico-decarbossilasi (AADC) (fase 1). Il conseguente triptofano decarbossilato è triptammina; questa subisce metilazione dall'enzima indoletilammina-N-metiltransferasi (INMT) che catalizza il trasferimento di un gruppo metilico dal cofattore S-adenosil metionina (SAM), tramite addizione nucleofila, alla triptammina. (fase 2). Questa reazione trasforma SAM in S-adenosilomocisteina (ESA), generando il prodotto intermedio N-metiltriptammina (NMT). NMT è a sua volta rimetilata tramite il medesimo procedimento (fase 3) formando il prodotto finale N,N-dimetiltriptammina.
Endogena
Nel 1961, Julius Axelrod trovò nel polmone di coniglio un enzima N-metiltransferasi in grado di mediare la biotrasformazione della triptammina in DMT. Da allora numerosi studi sono partiti alla ricerca di sottoprodotti della DMT endogena nei fluidi corporei e tessuti in esseri umani e altri mammiferi.[13][14] Successive ricerche (l'ultima nel 2005)[15] da parte di numerosi studiosi hanno permesso di rilevare tracce di NMT, bufotenina e di DMT nelle urine, nel sangue, in alcuni tessuti e nelle feci.[16] Negli esseri umani un gene che codifica l'enzima INMT è stato mappato sul cromosoma 7 in posizione 15.2bp-15.3bp.[17] Tracce di DMT sono state rinvenute in: plasma sanguigno (1.000 e 10.600 ng/L), sangue (50-790 ng/L), feci (50 ng/kg), urine (100 ng/L), rene (15 ng/kg), rachicentesi (2.330-7.210 ng/L).[15]
Farmacologia
Facendo parte del metabolismo del 5-HTP la DMT si trova spesso legata a:
- recettori serotoninergici (agisce come agonista parziale sui recettori, in particolare su 5-HT2A e 5-HT2C),[18]
- recettori adrenergici (in particolare su α1 e α2)
- Recettori sigma-1.[19] In particolare, la DMT è l'unico ligando agonista endogeno noto del recettore sigma-1, una delle cui funzioni è la modulazione del rilascio di Ca2+ e di inibire l'attività dei canali K+.
- Recettori della dopamina (D1)
Gli effetti psichedelici della DMT si possono probabilmente attribuire in gran parte alla attivazione del recettore serotoninergico 5-HT2A, anche se non si può escludere che recettori come 5-HT2C, sigma-1, e altri, possano giocare un ruolo importante.[20]

Meccanismo d'azione
Quando la DMT arriva al sistema nervoso centrale (oltre a legarsi al recettore sigma-1) va a legarsi ai recettori adrenergici (in particolare su α1 e α2) causando un aumento della pressione e una diminuzione della produzione di noradrenalina e di acetilcolina. Successivamente entra in competizione con la serotonina sui recettori 5-HT2A e 5-HT2C e con la dopamina sui recettori della dopamina (D1) causando così una diminuzione dei 2 neurotrasmettitori a livello postsinaptico ma senza cessarne la produzione, così che quando la sostanza viene metabolizzata i neurotrasmettitori ritornano tutti al loro posto. In questo modo non si creano né alterazioni chimiche né dipendenze al riguardo della DMT.[21]
Assunzione
Si può assumere respirandone i vapori, iniettando la sostanza per via intramuscolare, inalando direttamente la sostanza per via nasale o ingerirla sotto forma della bevanda ayahuasca.
La DMT diventa attiva oralmente solo se associata a MAO inibitori delle β-carboline: armina, armalina e tetraidroarmina; questi 3 principi attivi sono presenti nei rami di Banisteriopsis caapi, pianta principale della bevanda chiamata ayahuasca, e in altre piante del globo come la ruta siriana (Peganum harmala). Grazie a queste sostanze la degradazione periferica della DMT nello stomaco viene evitata e il principio attivo riesce ad agire. Fumata, invece, la DMT non ha bisogno di essere associata ad alcuna sostanza, gli effetti si possono riscontrare dopo pochissimi secondi dall'assunzione dei vapori. A seconda del tipo di assunzione è differente la durata dell'effetto: fumata svanisce dopo 15-20-30 minuti (a seconda della dose), ingerita la DMT, può durare anche 2-3 ore.[22]
Dosaggi
- Fumato
Il dosaggio medio per una persona di 60-70 kg, è di circa 50-60 milligrammi. Una volta estratta, generalmente viene assunto in tre modi:
- Fumando i cristalli tramite una pipa di vetro, bong o chiloom, trattenendo poi i vapori il più possibile, in un'unica boccata.
- Trasferendo tramite un solvente i cristalli estratti all'interno di un piccolo quantitativo di tabacco o qualsiasi altra erba fumabile da assumere tramite pipa di vetro, bong o chiloom in un'unica boccata.
- Mischiando i cristalli al tabacco, rollando una comune sigaretta.[23]
- Fumando una miscela infusa con DMT come la Changa, in cui estratti di piante contenenti DMT sono combinati con una miscela di varie erbe e vite e / o foglia di Ayahuasca per ottenere una miscela con il 20-50% di DMT.
- Disciolto e inalato per vaporizzazione.[24]
- Ingerito
Analisi sull'ayahuasca hanno stabilito che il dosaggio medio del MAO inibitore armina è di circa 0,1-0,12 grammi associato a 0,03-0,05 grammi di DMT. Altri esperimenti evincevano l'attività del composto con 0,1 grammi di Armalina idrocloridrico associati a 0,1 grammi di DMT.[25]
Effetti (inalazione dei vapori)
Sono stati fatti degli esperimenti e degli studi sulla DMT da parte di un importante esponente della rivoluzione psichedelica: Terence McKenna. In molte interviste da lui rilasciate o in conferenze parla di un viaggio breve di 20-30 minuti che porta la mente in una dimensione di trascendenza quasi totale e sembra che esseri provenienti da altri mondi facciano comparsa nella nostra realtà parlando e interagendo con noi. Mc Kenna parla di un suo viaggio ricorrente in cui delle palle da basket ingioiellate si autodribblano parlando in greco demotico.
Pochissimi secondi dopo l'assunzione dei vapori si riscontrano i primi effetti: allucinazioni visive vivide, maggiore nitidezza e brillantezza dei colori, alterazione di ciò che l'utilizzatore vede e in generale di tutti gli organi di senso, presenza di un ronzio/fischio ad alte frequenze, ricorrente in tutte le esperienze. Dopo questo primo stato di "semi-coscienza" si passa a uno stato nel quale il corpo "dorme", caratterizzato dalla percezione / visione di figure geometriche perfette come un caleidoscopio nel quale si muovono dei frattali coloratissimi e fluorescenti. Questa fase potrebbe essere descritta da alcuni come «l'esperienza di divenire uno "spazio obiettivo" di almeno tre dimensioni nel quale oggetti non terrestri ed entità possono verificarsi e interagire con noi. Esperienza in apparenza estremamente energetica, rapida e confusa le prime volte». Nel giro di una decina di minuti le allucinazioni perdono vividezza, si ripassa alla fase di "semi-coscienza" per poi tornare nel giro di altri 10-20 minuti alla normalità.[5][23][26]
Mc Kenna descrive alcune sue esperienze in questo modo:
«Un livello sonoro che diviene più denso e si materializza in piccole creature simili a gnomi fatti di un materiale simile all'ossidiana, emesso dal corpo, dalla bocca e dagli organi sessuali, per tutta la durata del suono. È effervescente, fosforescente e indescrivibile. Le metafore linguistiche diventano inutili, perché questa materia è al di là del linguaggio, non un linguaggio fatto di parole, un linguaggio che diviene le cose che descrive»
Terence McKenna sostiene inoltre che non sia una molecola pericolosa per la salute, a meno che uno non muoia dallo stupore. Effettivamente, non ci sono a oggi prove di danni fisici causati da questa sostanza, ma è possibile che un utilizzo continuato possa indurre psicosi e altre disfunzioni difficilmente prevedibili data la sua bassa diffusione; c'è però da sottolineare che casi simili non si sono mai presentati nella storia. L'unica famiglia di psichedelici notoriamente dannosa per l'uomo è la famiglia 25I-NBOMe, facile ed economica da produrre e spacciata spessissimo per LSD, altra sostanza notoriamente atossica.[3][27]
Stato legale
Attualmente è un composto classificato nella categoria 1 negli Stati Uniti. In altri paesi del mondo come Canada, Francia, Regno Unito, Italia (Tabella 1)[28] è illegale il possesso della molecola, ma non della pianta che la contiene. In Brasile recentemente è stata resa legale per culti e cerimonie religiose.[29]

Piante e funghi contenenti DMT[30]
- Justicia pectoralis [DMT]
- Amanita citrina [DMT, 5MD]
- Amanita porphyria [5MD]
- Delosperma sp. [DMT]
- Arundo donax [DMT]
- Phalaris arundinacea 0.06 % DMT
- Phalaris tuberosa (= P. aquatica) 0.1% - 1.0% DMT [31]
- Phragmites australis [DMT]
- Phalaris brachystachys (= "P. canariensis) [DMT]
- Acacia confusa 0.02 % DMT
- Acacia maidenii [DMT]
- Acacia nubica [DMT]
- Acacia phlebophylla 0.30 % DMT
- Acacia polyacantha subsp. campylacantha 0.20 % DMT
- Acacia senegal 0.10% DMT
- Acacia simplicifolia 0.81 % DMT
- Anadenanthera colubrina var. cebil (= Piptadenia macrocarpa) [DMT]
- Anadenanthera peregrina [DMT, 5MD]
- Parapiptadenia excelsa(= Anadenanthera excelsa) [DMT]
- Desmanthus illinoensis 0.34% DMT
- Desmodium caudatum [DMT]
- Desmodium gangeticum [DMT, 5MD]
- Desmodium gyrans [DMT, 5MD]
- Desmodium pulchellum [DMT,5 MD]
- Desmanthus leptolobus 0.14 % DMT
- Lespedeza bicolor var. japonica [DMT, 5MD]
- Desmodium racemosum [5MD]
- Desmodium triflorum 0.0004 % DMT
- Mimosa hostilis = tenuiflora 0.50/1.00 % DMT
- Mimosa ophthalmocentra 1.50 % DMT
- Mimosa scabrella [DMT]
- Mucuna pruriens [DMT, 5MD]
- Petalostylis labicheoides var. casseoides [DMT]
- Banisteriopsis muricata (= B. argentea) [DMT]
- Diplopterys cabrerana (=Banisteriopsis rusbyana) 0.50/1.00 % DMT
- Erythroxylum pungens 0.09 % DMT[32]
- Iryanthera ulei [5MD]
- Osteophloeum platyspermum [DMT, 5MD]
- Virola calophylla [DMT, 5MD]
- Virola carinata [DMT]
- Virola divergens [DMT]
- Virola elongata (=Virola theiodora) [DMT, 5MD]
- Virola melinonii [DMT]
- Virola multinervia [DMT, 5MD]
- Virola pavonis [DMT]
- Virola peruviana [DMT, 5MD]
- Virola rufula [DMT, 5MD]
- Virola sebifera [DMT]
- Virola venosa [DMT, 5MD]
- Testulea gabonensis [DMT]
- Erigonum sp. [DMT]
- Psychotria carthagenensis [DMT]
- Psychotria viridis (= P. psychotriaefolia) 0.30 / 1.00 % DMT
- Dictyoloma vandellianum [5MD]
- Dutaillyea drupacea [5MD]
- Dutaillyea oreophila [5MD]
- Evodia rutaecarpa [5MD]
- Limonia acidissima [5MD]
- Melicope leptococca [5MD]
- Pilocarpus organensis [5MD]
- Vepris ampody [DMT]
- Zanthoxylum arborescens [DMT]
- Zanthoxylum procerum [DMT]
Filmografia
- Enter the void, 2009 di Gaspar Noè
- DMT: The Spirit Molecule, 2010 di Mitch Schultz
Note
- ^ Copia archiviata, su jeremybigwood.net. URL consultato il 18 gennaio 2009 (archiviato dall'url originale il 9 dicembre 2008). DMT scritto con etnobotanico e storico di enteogeni Jonathan Ott - Head Magazine, novembre 1977
- ^ Barker, S. A., Monti, J. A. & Christian, S. T., N, N-dimethyltryptamine: an endogenous hallucinogen., su doi.org, Int. Rev. Neurobiol. 22, 83-110 (1981)..
- ^ a b Rick Strassman. DMT, The Spirit Molecule, Park Street Press, 2001, ISBN 0-89281-927-8
- ^ When the endogenous hallucinogenic trace amine N,N-dimethyltryptamine meets the sigma-1 receptor. Su TP, Hayashi T, Vaupel DB. Cellular Pathobiology Section, Cellular Neurobiology Research Branch, Intramural Research Program, National Institute on Drug Abuse, National Institutes of Health, Baltimore, MD 21224, USA. TSU@intra.nida.nih.gov https://www.ncbi.nlm.nih.gov/pubmed/19278957?itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_RVDocSum&ordinalpos=11
- ^ a b "Dmt, iperspazio e osservazioni ad infinite dimensioni" di Riccardo Tristano Tuis http://www.psiconautica.in/index.php?option=com_content&view=article&id=1315:dmt-iperspazio-e-osservazioni&catid=28:phantastica&Itemid=3 Archiviato il 6 ottobre 2014 in Internet Archive.
- ^ (EN) Jon G. Dean, Liu Tiecheng e Sean Huff, Biosynthesis and Extracellular Concentrations of N,N-dimethyltryptamine (DMT) in Mammalian Brain, in Nature, Scientific Report, 9, n. 1, 27 giugno 2019, pp. 1-11, DOI:10.1038/s41598-019-45812-w. URL consultato il 25 luglio 2020.
- ^ M. L. Pochettino, A. R. Cortella e M. Ruiz, Hallucinogenic Snuff from Northwestern Argentina: Microscopical Identification of Anadenanthera colubrina var. cebil (Fabaceae) in Powdered Archaeological Material, in Economic Botany, vol. 53, n. 2, 1999, pp. 127-132. URL consultato il 21 maggio 2019.
- ^ (EN) José M. Capriles, Christine Moore e Juan Albarracin-Jordan, Chemical evidence for the use of multiple psychotropic plants in a 1,000-year-old ritual bundle from South America, in Proceedings of the National Academy of Sciences, 1º maggio 2019, p. 201902174, DOI:10.1073/pnas.1902174116. URL consultato il 21 maggio 2019 (archiviato dall'url originale il 28 maggio 2019).
- ^ (EN) Yasmin Anwar, Media Relations| May 6, 2019May 16, 2019, Ayahuasca fixings found in 1,000-year-old Andean sacred bundle, su Berkeley News, 6 maggio 2019. URL consultato il 21 maggio 2019.
- ^ Ayahuasca analogues: Pangæan entheogens - Jonathan Ott - 1994 - ISBN 9780961423452
- ^ http://www.internazionale.it/opinione/vanni-santoni/2017/01/01/psichedelia-rinascimento-medicina
- ^ https://motherboard.vice.com/read/ayahuasca-a-possible-cure-for-alcoholism-and-depression
- ^ https://www.sciencemag.org/content/134/3475/343 "La formazione enzimatica di metaboliti psicotomimetici da composti normalmente presenti - Axelrod J. - 1961 - PMID 13685339
- ^ (EN) Jimo Borjigin, Michael M. Wang e Rick J. Strassman, Biosynthesis and Extracellular Concentrations of N,N-dimethyltryptamine (DMT) in Mammalian Brain, in Scientific Reports, vol. 9, n. 1, 27 giugno 2019, p. 9333, DOI:10.1038/s41598-019-45812-w. URL consultato il 3 luglio 2019.
- ^ a b https://www.ncbi.nlm.nih.gov/pubmed/16095048 Potenzialmente allucinogeni recettore 5-idrossitriptamina ligandi Bufotenina e dimetiltriptamina nel sangue e nei tessuti - Kärkkäinen, J.; Forsström T.; Tornaeus J.; Wähälä K.; Kiuru P.; Honkanen A.; Stenman U.-H.; Turpeinen U.; Hesso A. - 2005 - PMID 16095048
- ^ https://www.nature.com/nature/journal/v206/n4988/abs/2061052a0.html Tryptamine, N,N-Dimethyltryptamine, N,N-Dimethyl-5-hydroxytryptamine and 5-Methoxytryptamine in Human Blood and Urine - Franzen F., Gross H. - 1965 - PMID 5839067
- ^ https://www.ncbi.nlm.nih.gov/pubmed/10552930 "Human indolethylamine N-methyltransferase: cDNA cloning and expression, gene cloning, and chromosomal localization." - Thompson MA, Luna E., Kim UJ, Xu J., Siciliano MJ, Weinshilboum RM - 1999 - PMID 10.552.930
- ^ (EN) Christopher Timmermann, Leor Roseman e Sharad Haridas, Human brain effects of DMT assessed via EEG-fMRI, in Proceedings of the National Academy of Sciences, vol. 120, n. 13, 28 marzo 2023, pp. e2218949120, DOI:10.1073/pnas.2218949120. URL consultato il 21 marzo 2023.
- ^ Copia archiviata, su medicinamoksha.blogspot.com. URL consultato il 30 aprile 2019 (archiviato dall'url originale il 13 settembre 2018).
- ^ Proprietà farmaco-tossicologiche dell'Ayahuasca, su psiconautica.in. URL consultato il 18 luglio 2011 (archiviato dall'url originale il 4 marzo 2016).
- ^ Neurotrasmissione - Malattie neurologiche, su Manuali MSD Edizione Professionisti. URL consultato il 10 settembre 2023.
- ^ http://www.psiconautica.in/index.php?option=com_content&view=article&id=1263:ayahuasca-e-analoghi-enteogeni-universali-per-il-nuovo-millennio&catid=28:phantastica&Itemid=3 Archiviato il 27 dicembre 2014 in Internet Archive. >"AYAHUASCA E ANALOGHI: ENTEOGENI UNIVERSALI PER IL NUOVO MILLENNIO" di Jonathan Ott - 1994 - ISBN 9780961423452
- ^ a b Erowid Experience Vaults: DMT (also N,N-DMT) Main Index
- ^ (EN) Mike Power, I Sell DMT Vape Pens So People Can 'Break Through' at Their Own Speed, su vice.com, 5 giugno 2020. URL consultato il 14 luglio 2020.
- ^ Ayahuasca e analoghi
- ^ Livelli di esperienza con DMT http://psiconautica.in/index.php?option=com_content&view=article&id=1321:livelli-di-esperienza-con-dmt&catid=28:phantastica&Itemid=3 Archiviato il 9 marzo 2016 in Internet Archive.
- ^ Szára S. DMT at fifty. Neuropsychopharmacol Hung. 2007 Dec; 9(4):201-5.
- ^ salute.gov.it Archiviato il 27 giugno 2011 in Internet Archive., controllare Tabella I
- ^ autorizzata DMT per finalità religiose http://droghe.aduc.it/notizia/autorizzato+allucinogeno+finalita+religiosa_115835.php
- ^ Category:DMT su: wiki.dmt-nexus.me
- ^ "Ayahuasca-Iike" effects obtained with Italian plants, su: catbull.com
- ^ Isolation, spectral characterization, molecular docking, and cytotoxic activity of alkaloids from Erythroxylum pungens O. E. Shulz, su: www.ncbi.nlm.nih.gov
Bibliografia
- Rick Strassman, Spazio Interiore, 2014, DMT: La Molecola dello spirito, ISBN 978-88-97864-32-5
- Terence Mckenna, ShaKe Edizioni, 1993, Vere allucinazioni, ISBN 978-88-88865-60-7
- 1994 -Terence Mckenna, The Invisible Landscape (HarperSanFrancisco; Reprint edition) ISBN 0-06-250635-8
- Graham Hancock, Tea edizioni, 2005, Sciamani, i maestri dell'umanità, ISBN 8879728245
- Giorgio Samorini, Shake Edizioni, 2016, Jurema, la pianta della visione. Dai culti del Brasile alla Psiconautica di frontiera, ISBN 9788897109433
- Walter Menozzi, Ayahuasca: la liana degli spiriti ; il sacramento magico-religioso dello sciamanismo amazzonico, 2015, ISBN 978-88-97864-33-2.
Voci correlate
- Ghiandola pineale
- Terence McKenna
- Ayahuasca
- Frattale
- Enteogeno
- LSD
- Serotonina
- Dimensione extra
- Locus ceruleus
- Psiconautica
Altri progetti
 Wikiquote contiene citazioni di o su dimetiltriptamina
Wikiquote contiene citazioni di o su dimetiltriptamina Wikimedia Commons contiene immagini o altri file su dimetiltriptamina
Wikimedia Commons contiene immagini o altri file su dimetiltriptamina
Collegamenti esterni
- https://wiki.dmt-nexus.me/DMT
- http://thespiritmolecule.com/ Archiviato il 19 settembre 2012 in Internet Archive. Video documentario sulla Dimetiltriptamina
- Dmt, iperspazio e osservazioni ad∞ dimensioni, su psiconautica.in. URL consultato il 6 aprile 2020 (archiviato dall'url originale il 6 marzo 2016).
| Controllo di autorità | Thesaurus BNCF 68108 · LCCN (EN) sh00000063 · GND (DE) 4779583-9 · BNF (FR) cb14651008s (data) · J9U (EN, HE) 987007290699105171 |
|---|
