Addizione elettrofila
L'addizione elettrofila è una reazione di addizione in cui i reagenti sono in genere idrocarburi insaturi.
Meccanismo di reazione
Il meccanismo di reazione coinvolge la scissione eterolitica della molecola di reagente, che dà origine a due specie chimiche di carica differente. Il gruppo avente carica positiva, dunque povero di elettroni, attacca per primo il substrato nella zona del legame multiplo. Si ha quindi la rottura di legami π e la formazione di legami σ.
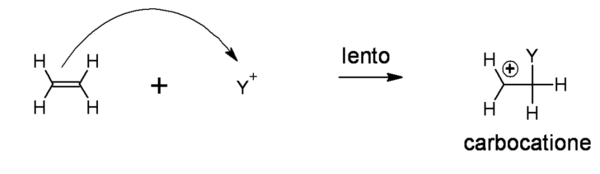
La reazione avviene in due stadi:
- 1° stadio: l'elettrofilo attacca il legame π, poiché gli elettroni π del doppio legame formano un legame più debole di quelli σ. Il doppio legame si comporta come una fonte di elettroni nei confronti dei reattivi in cerca di elettroni. L'attacco da parte dell'elettrofilo porta alla formazione di un intermedio carico positivamente (il carbocatione).
- 2° stadio: si ha la combinazione fra il carbocatione e la specie nucleofila. Questo stadio è molto veloce, in quanto il carbocatione non è un intermedio stabile.
Orientazioni delle addizioni elettrofile
Sia i reagenti che gli alcheni possono essere simmetrici o asimmetrici. Se l'alchene è simmetrico, è possibile ottenere un solo prodotto di addizione. Altrimenti, in teoria, sarebbe possibile ottenere due prodotti di addizione.

La reazione di addizione è regiospecifica, e segue la regola di Markovnikov:
- Quando un reagente asimmetrico si addiziona ad una alchene asimmetrico, la parte elettropositiva del reagente si attacca all'atomo di carbonio del doppio legame che è legato al maggior numero di atomi di idrogeno.[1]
Reazioni di addizione
- addizione nucleofila
- idrogenazione
- idratazione
- addizione di acidi
- addizione di alogeni
- reazione di Diels-Alder
- ossimercurazione e demercurazione
- idroborazione.
Note
Bibliografia
- T. W. Graham Solomons, Chimica organica, a cura di G. Ortaggi, D. Misiti, 2ª ed., Bologna, Zanichelli, 1988, ISBN 88-080-9414-6.