Uracile
| Uracile | |
|---|---|
 | |
| Nome IUPAC | |
| 2,4-diossipirimidina | |
| Abbreviazioni | |
| U | |
| Nomi alternativi | |
| 2,4-1H,3H-pirimidindione | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H4N2O2 |
| Massa molecolare (u) | 112,08 |
| Aspetto | solido cristallino bianco |
| Numero CAS | |
| Numero EINECS | 200-621-9 |
| PubChem | 1174 |
| DrugBank | DBDB03419 |
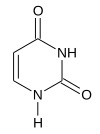
| SMILES | C1=CNC(=O)NC1=O |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 335 °C (608 K) con decomposizione |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −429,4 |
| C0p,m(J·K−1mol−1) | 120,5 |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | --- [1] |
L'uracile è una delle due basi azotate pirimidiniche che formano i nucleotidi dell'acido nucleico RNA. Tramite due legami a idrogeno nell'RNA si lega all'adenina (A). Legata a una molecola di ribosio forma l'uridina. Come tale l'uridina non ha quasi nessun coinvolgimento metabolico. Deve essere prima convertita nella sua forma fosforilata completa (UTP) e da qui prendere diverse vie metaboliche:
- incorporazione nella struttura nell'RNA per azione della RNA polimerasi II;
- essere convertita a derivati glucidici come l'UDP-glucosio e l'UDP-galattosio, che intervengono nei fenomeni di costruzione delle strutture polisaccaridiche cellulari (zuccheri complessi con funzione strutturale)
- sfruttare il derivato difosfato (UDP) per sintetizzare la base timina. Viene utilizzata la ribonucleotide reduttasi per ridurre l'UDP in dUDP, la nucleotide difosfato chinasi per fosforilarlo a dUTP e infine una idrolisi per portarlo al dUMP con rilascio di pirofosfato. L'idrolisi di quest'ultimo permette di sbilanciare la reazione verso i prodotti, per ridurre il più possibile la presenza di dUTP nella cellula. Date le somiglianze tra uracile e timina, infatti, il dUTP potrebbe entrare erroneamente nel DNA, non riuscendo la polimerasi a discriminare bene le due basi azotate.
Il dUMP viene poi metilato per azione della timidilato sintetasi, utilizzando un metile proveniente da N5, N10-metilen-tetraidrofolato. Il prodotto di tale reazione sarà la dTMP desiderata e il diidrofolato. La base è ora pronta per entrare nella struttura del DNA.
Quest'ultimo passaggio è stato sfruttato ampiamente nella chemioterapia antitumorale con il farmaco 5-fluoro-uracile (5FU), inibitore suicida e irreversibile della timidilato sintetasi. Ha trovato infatti ampio uso nella terapia del carcinoma mammario, di quello del colon, nel tumore epatico e altri tipi. Oggi si preferiscono dei suoi derivati più efficaci (Fluoro-desossiuridina e Tegafur), che hanno un profilo di farmacocinetica e tossicità migliori.
Note
- ^ Sigma Aldrich; rev. del 08.04.2011
Altri progetti
 Wikimedia Commons contiene immagini o altri file su uracile
Wikimedia Commons contiene immagini o altri file su uracile
Collegamenti esterni
- uracile, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- uracile, in Dizionario delle scienze fisiche, Istituto dell'Enciclopedia Italiana, 1996.
- uracile, in Dizionario di medicina, Istituto dell'Enciclopedia Italiana, 2010.
- (EN) uracil, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4187149-2 |
|---|

