Gluconzuur
| Gluconzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
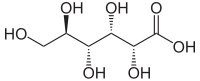
Structuurformule van D-gluconzuur
| ||||
| Algemeen | ||||
| Molecuulformule | C6H12O7 | |||
| IUPAC-naam | (2R,3S,4R,5R)-2,3,4,5,6-pentahydroxyhexaanzuur | |||
| Andere namen | gluconzuur | |||
| Molmassa | 196,16 g/mol | |||
| CAS-nummer | 526-95-4 | |||
| EG-nummer | 208-401-4 | |||
| Wikidata | Q407569 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,24 g/cm³ | |||
| Smeltpunt | 131 °C | |||
| Kookpunt | 417 °C | |||
| Goed oplosbaar in | water | |||
| Nutritionele eigenschappen | ||||
| ADI | 0-50 mg/kg lichaamsgewicht | |||
| Type additief | zuurteregelaar | |||
| E-nummer | E574 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Gluconzuur is een carbonzuur met zes koolstofatomen en vijf hydroxylgroepen. Het komt in de natuur voor in onder meer honing en wijn: het is een oxidatieproduct van druivensuiker (D-glucose). Het is een kleurloze kristallijne vaste stof, die zeer goed oplosbaar is in water. In neutraal water vormt gluconzuur het gluconaat anion; zouten van gluconzuur worden gluconaten genoemd. In zuur midden vormt gluconzuur door afsplitsing van water glucono-delta-lacton.
Gluconzuur is niet giftig en gemakkelijk biologisch afbreekbaar, en heeft uiteenlopende toepassingen in de voedingsmiddelenindustrie, geneeskunde, cosmetica, bouwnijverheid en andere sectoren.
Productie
Gluconzuur wordt commercieel geproduceerd door de oxidatie van de aldehydegroep in glucose:


De oxidatie kan gebeuren langs elektrochemische weg of via chemische oxidatie, maar gebeurt het vaakst door fermentatie van micro-organismen, waaronder de schimmel Aspergillus niger. Deze zetten de natuurlijke suiker D-glucose om in D-gluconzuur met behulp van de enzymcombinatie glucoseoxidase + katalase. Glucoseoxidase katalyseert de omzetting van glucose in gluconzuur:
D-glucose + H2O + O2 → D-gluconzuur + H2O2
Katalase breekt het waterstofperoxide dat bij de omzetting ontstaat, af tot water en zuurstof. Dit is belangrijk omdat waterstofperoxide glucoseoxidase inactief maakt. Bovendien ontstaat zo zuurstof die voor de glucoseomzetting kan gebruikt worden.
Deze omzetting kan ook gebeuren zonder micro-organismen. De reactie gebeurt dan in waterige oplossing met de vooraf geïsoleerde enzymen glucoseoxidase en katalase als katalysator. Om het gevormde zuur te neutraliseren kan men een base zoals natrium- of calciumhydroxide toevoegen, zodat er natriumgluconaat of calciumgluconaat ontstaat [1].
Toepassingen
- Gluconzuur is een toegelaten voedingsmiddelenadditief (zuurteregelaar). Het E-nummer van gluconzuur is E574. Het wordt onder meer gebruikt in niet-alcoholische dranken en in puddingpoeder. Naast gluconzuur zelf zijn ook glucono-delta-lacton en een aantal zouten van gluconzuur toegelaten als voedingsmiddelenadditief (natrium-, kalium-, calcium- en ijzer(II)gluconaat).
- De omzetting van glucose in gluconzuur wordt gebruikt in glucosemeetsystemen voor diabetespatiënten.
- Gluconaten, waaronder ijzer- of zinkgluconaat, worden in de geneeskunde en in voedingssupplementen gebruikt om een tekort aan sporenelementen te verhelpen. Het gluconaation wordt goed door het lichaam opgenomen en neemt het corresponderende metaalion met zich mee.
- Het gluconaat-anion is een goed cheleermiddel dat met een aantal kationen van metalen waaronder Ca2+, Fe2+, Al3+ en andere zware metalen, metaalcomplexen vormt. Gluconzuur kan gebruikt worden tegen vergiftiging met zware metalen, en in industriële toepassingen zoals het reinigen of polijsten van metaaloppervlakken.
- Gluconzuur en gluconaten worden gebruikt in industriële en huishoudelijke schoonmaakmiddelen en hygiënische producten, en in de papier- en textielindustrie.
- Natriumgluconaat is een additief in cementmengsels.

