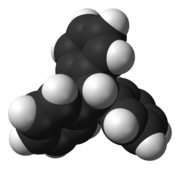
Trifenylometan
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny |
C19H16 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
(C6H5)3CH, Ph3CH, TrH | ||||||||||||||||||||||
| Masa molowa |
244,33 g/mol | ||||||||||||||||||||||
| Wygląd |
bezbarwne ciało stałe | ||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||
| PubChem |
{{{nazwa}}}, [w:] PubChem [online], United States National Library of Medicine, CID: (ang.). | ||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
Trifenylometan (trytan, TrH) – węglowodór aromatyczny, pochodna metanu, w której trzy atomy wodoru zastąpione zostały trzema pierścieniami benzenowymi. Jest podstawowym składnikiem wielu barwników syntetycznych (barwniki triarylometanowe – niektóre z nich używane jako wskaźniki pH). Rozpuszczalny w niepolarnych rozpuszczalnikach organicznych i nierozpuszczalny w wodzie. Stosowany jako stabilizator polimerów i paliw. Grupa trifenylometanowa nosi nazwę grupy trytylowej, np. chlorek trifenylometylu to chlorek trytylu.
Otrzymywanie
Trifenylometan można otrzymać w reakcja Friedla-Craftsa z benzenu i chloroformu wobec katalizatora – chlorku glinu:
- 3 C6H6 + CHCl3 → Ph3CH + 3 HCl
W reakcji czterochlorku węgla z benzenem wobec tego samego katalizatora powstaje addukt chlorku trytylu z chlorkiem glinu, który jest hydrolizowany przez rozcieńczone kwasy do trytanu[1]:
- 3 C6H6 + CCl4 + AlCl3 → Ph3CCl·AlCl3
- Ph3CCl•AlCl3 + HCl → Ph3CH
Wykorzystywana jest również synteza trifenylometanu z chlorku benzalu (PhCHCl2) i benzenu[2]:
- C6H5CHCl2 + 2C6H6 → (C6H5)3CH + 2HCl / 130–140 °C wobec BeCl2
Kwasowość
pKa wodoru przy centralnym atomie węgla w cząsteczce trifenylometanu wynosi około 31. Jego wysoka kwasowość w stosunku do innych węglowodorów wynika ze stabilizacji płaskiego anionu trytylowego przez rozległą delokalizację elektronów na trzech pierścieniach fenylowych. Jednakże taka stabilizacja nie zachodzi jednocześnie we wszystkich trzech pierścieniach fenylowych wskutek występowania efektów sterycznych.
Anion trytylowy silnie absorbuje światło widzialne, przez co jest czerwony. To zabarwienie może służyć jako wskaźnik w podtrzymywaniu warunków bezwodnych w obecności wodorku wapnia, będącego wystarczająco silną zasadą, żeby utworzyć anion trytylowy. Gdy cały wodorek wapnia przereaguje z wodą, roztwór odbarwia się.
Aniony trytylowe mogą być również tworzone w reakcji chlorku trytylu z metalami alkalicznymi[3]:
- (C6H5)3CCl + 2 Na → (C6H5)3CNa + NaCl
Przed popularyzacją butylolitu produkt powyższej reakcji był stosowany jako silna nienukleofilowa zasada.
Barwniki triarylometanowe
Przykładami barwników triarylometanowych są:
Zobacz też
- Trifenylometyl – grupa funkcyjna pochodząca od TrH.
- ↑ J. F. Norris. Triphenylmethane. „Organic Syntheses”. Coll. Vol. 1, s. 548, 1941. (ang.).
- ↑ Hellmut Bredereck, Gerhard Lehmann, Christian Schönfeld, Edwin Fritzsche. Berylliumchlorid in organischen Reaktionen. „Berichte der deutschen chemischen Gesellschaft”. 72, s. 1414 – 1429, 1939. DOI: 10.1002/cber.19390720717. (niem.).
- ↑ W. B. Renfrow Jr i C. R. Hauser. Triphenylmethylsodium. „Organic Syntheses”. Coll. Vol. 2, s. 607, 1943. (ang.).