Walinomycyna
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C54H90N6O18 | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
1111,32 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Wygląd |
beżowy krystaliczny proszek | ||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||
| PubChem |
{{{nazwa}}}, [w:] PubChem [online], United States National Library of Medicine, CID: (ang.). | ||||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||
Walinomycyna – organiczny związek chemiczny pochodzenia naturalnego, cykliczny oligopeptyd z grupy depsypeptydów, antybiotyk z grupy streptogramin B. Jest jonoforem o wysokiej selektywności wiązania kationu potasu K+, który może być transportowany w postaci kompleksu przez błony komórkowe[1]. Proces ten obniża naturalny potencjał elektrochemiczny komórki. Ze względu na bardzo wysoką toksyczność związek ten nie jest stosowany w leczeniu ludzi ani zwierząt. Walinomycyna powstaje naturalnie w procesach metabolicznych bakterii Streptomyces fulvissimus[2], a także innych promieniowców z rodzaju Streptomyces (patogennych dla człowieka), np. S. tsusimaensis. Dowiedziono również, że walinomycyna produkowana jest przez paciorkowca kałowego – bakterie z rodzaju Enterococcus[3]. Biosynteza walinomycyny przez te mikroorganizmy została dokładnie przebadana i wyjaśniona[4][5]. Badania nad tym związkiem przyczyniły się do poznania mechanizmu działania jonoforów[6].
Historia
Walinomycyna jest jednym z najdokładniej przebadanych antybiotyków jonoforowych. Wyizolowana została po raz pierwszy w 1955 roku ze szczepu Streptomyces fulvissimus[2]. Berton Pressman zaobserwował udział walinomycyny w transporcie jonów przez błony biologiczne[7]. W 1964 roku Pressman wraz z Cyrilem Moore'em wykazali, że działanie walinomycyny jest silnie związane z obecnością kationów potasu[8]. Wykazali oni, że walinomycyna rozprzęga procesy fosforylacji oksydacyjnej w obecności kationów potasu i rubidu, lecz nie w obecności kationów sodu[9][10][11]. Pressman wysnuł hipotezę, że walinomycyna wpływa na działanie pompy sodowo-potasowej – jedynego znanego w tamtych czasach sposobu transportu jonów przez błony[12]. Trzy lata później, w 1967 roku Pressman wykazał, że walinomycyna tworzy związki kompleksowe z kationami potasu i może transportować te jony przez błony komórkowe samodzielnie. To przełomowe odkrycie uznawane jest za początek chemii jonoforów[6].
Struktura cząsteczki

HyValer – reszta kwasu 2-hydroksyizowalerianowego
Lac – reszta kwasu mlekowego
Val – reszta waliny
Walinomycyna należy do grupy depsypeptydów, czyli cyklicznych oligopeptydów połączonych zarówno wiązaniami amidowymi jak i estrowymi. Cząsteczka walinomycyny składa się z trzech powtarzających się fragmentów zbudowanych z L-waliny, kwasu D-2-hydroksyizowalerianowego i D-waliny, kwasu L-mlekowego, połączonych w pierścień[1]. Łącznie w cząsteczce walinomycyny znajduje się 12 grup karbonylowych (6 amidowych i 6 estrowych).
Makrocykliczny pierścień tego depsypeptydu składa się z 36 atomów, a jego średnica w układzie płaskim jest o wiele za duża, aby kompleksować we wnętrzu kation potasu. Cząsteczka walinomycyny nie jest sztywna, lecz może ulegać znacznym zmianom konformacyjnym. Analiza rentgenowska wykazała, że walinomycyna może krystalizować w rożnych układach krystalograficznych (trójskośnym, jednoskośnym oraz rombowym) i może różnić się układem wiązań wodorowych w zależności od użytego do krystalizacji rozpuszczalnika. Ponadto w hydrofilowej wnęce walinomycyny mogą być związane wodorowo cząsteczki wody[13][14][15].
Kompleksy
Kompleks z kationem potasu

Badania rentgenostrukturalne kompleksu walinomycyny z kationem potasu pokazały, że struktura ligandu w kompleksie zmienia się znacząco w porównaniu do struktury samego ligandu[16][17]. Proces kompleksowania kationu potasu wymusza zasadnicze zmiany konformacyjne oraz zmiany w układzie wiązań wodorowych. Walinomycyna przyjmuje tzw. „konformację piłki tenisowej” owijając się wokół kationu. Kation potasu koordynowany jest w tym kompleksie przez sześć atomów tlenu walinomycyny pochodzących od grup karbonylowych waliny, natomiast wszystkie amidowe atomy wodoru biorą udział w tworzeniu wewnątrzcząsteczkowych wiązań wodorowych. Kation potasu jest zamknięty w hydrofilowej wnęce wewnątrz cząsteczki, natomiast grupy alkilowe (izo-propylowe i metylowe) skierowane są na zewnątrz cząsteczki tworząc tzw. hydrofobową sferę zewnętrzną. Taki kształt cząsteczki kompleksu sprawia, że jest on rozpuszczalny w rozpuszczalnikach niepolarnych oraz w błonach lipidowych.
Kompleksy z innymi kationami
Badania kompleksów z innymi kationami, np. z kationem sodu czy rubidu przyczyniły się do wysunięcia przez Steinraufa teorii, która zakłada, iż proces kompleksowania kationu potasu przez cząsteczkę walinomycyny jest związany ze stopniowym zrywaniem wiązań wodorowych pomiędzy ligandem a cząsteczkami wody[17][18]. W miejsce zerwanych wiązań wodorowych pojawiają się nowe wiązania koordynacyjne wiążące kation potasu. Cząsteczki wody mogą jednak wchodzić w sferę koordynacyjną kationu.
Przeprowadzone symulacje komputerowe dynamiki molekularnej (MD) sugerują natomiast, że szybkość procesu dekompleksowania kationu nie jest związana z tworzeniem się pośredniego adduktu z wodą, jak sugerował Pressman[7], lecz z właściwym ułożeniem cząsteczek kompleksu na granicy błony[19].
Stała trwałości kompleksu walinomycyny z kationem potasu jest 10 000 razy wyższa niż z kationem sodu[20][21]. Selektywność kompleksowania kationów jednowartościowych przez walinomycyny jest następująca[7][21]: Rb+ > K+ > Cs+ > Ag+ > NH+4 > Na+ > Li+.
Walinomycyna kompleksuje kationy metali drugiej grupy układu okresowego ze wzrastająca selektywnością[7]: Ba2+ > Ca2+ > Sr2+ > Mg2+.
Najnowsze badania pokazują, że jonofor ten tworzy kompleksy z dwuwartościowymi kationami metali przejściowych takimi jak[22][23]: Cu2+, Zn2+, Cd2+, Pb2+, UO2+2, Fe2+, Co2+ i Ni2+.
Obliczone stałe trwałości dla niektórych kompleksów maleją w szeregu[23]: Pb2+ > Cu2+ > UO2+2, Zn2+ > Ni2+ > Co2+, Cd2+ > Fe2+.
Mechanizm działania antybiotycznego
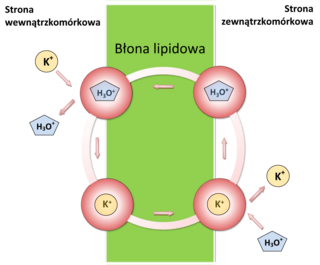
Wyjaśnienie mechanizmu kompleksowania kationu potasu przez walinomycynę było niezbędne do zrozumienia procesu transportu tego kationu przez błonę wewnętrzną mitochondrium i wpływu na proces fosforylacji oksydacyjnej. Mechanizm działania antybiotycznego walinomycyny wynika bowiem z selektywnego transportu kationów potasu przez błonę lipidową z macierzy mitochondrialnej do przestrzeni międzybłonowej tego organellum. Transport ten zakłóca naturalny gradient stężenia kationów K+ po obu stronach błony powodując zaburzenia procesów energetycznych komórki. Początkowo wydawało się, że walinomycyna jest zdolna do kompleksowania wyłącznie kationów potasu i rubidu, jednak przypuszczenia te zostały szybko rozwiane.
Jonofor ten tworzy kompleksy z kationami niemalże wszystkich litowców od litu po cez[24][25][26]. Selektywność kompleksowania kationów potasu i rubidu jest natomiast dużo wyższa niż kationu sodu, co ma zasadniczy wpływa na mechanizm jej działania bakteriobójczego[20]. Według czeskich naukowców mechanizm działania walinomycyny nie jest jednak związany wyłącznie z transportem kationów K+ przez błonę wewnętrzną mitochondriów, lecz równocześnie z transportem jonów hydroniowych (H3O+) w przeciwną stronę[27]. Taki transport jonów w obie strony przypomina rodzaj antyportu, nie jest to jednak transport aktywny. Badania spektroskopowe potwierdziły zdolność kompleksowania jonu hydroniowego przez walinomycynę[28]. Na podstawie badań woltamperometrycznych zasugerowano natomiast, że walinomycyna może transportować zarówno kation jak i anion[29]. Mechanizm takiego transportu nie został jeszcze wyjaśniony.
Zastosowanie
Walinomycyna wykazuje silne działanie przeciwnowotworowe[30], przeciwgrzybicze[31], przeciwbakteryjne a nawet przeciwwirusowe[32]. Jednak, jak większość antybiotyków depsypeptydowych, wykazuje wysoką toksyczność, dlatego nie może być stosowana w terapii[33][34]. Najnowsze badania in vitro dowiodły, że walinomycyna wykazuje najlepsze działanie antybiotyczne przeciw śmiertelnemu wirusowi SARS-CoV w zakażonych komórkach Vero E6. Wirus ten wywołuje zespół ostrej ciężkiej niewydolności oddechowej[35], a jego epidemia wybuchła w Chinach w 2002 roku i rozprzestrzeniła się z Dalekiego Wschodu, aż do krajów Ameryki Północnej. Walinomycyna znalazła natomiast zastosowanie w elektrodach jonoselektywnych (ISE) do wykrywania kationów potasu[36].
Zobacz też
Przypisy
Linki zewnętrzne
- Karl Harrison: Valinomycin. [w:] 3dchem.com [on-line]. [dostęp 2011-09-15]. (ang.). – model cząsteczki w 3D
- ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep1BŁĄD PRZYPISÓW - ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep2BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep3BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep4BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep5BŁĄD PRZYPISÓW - ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep6BŁĄD PRZYPISÓW - ↑ a b c d Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep7BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep8BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep9BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep10BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep11BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep12BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep13BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep14BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep15BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep16BŁĄD PRZYPISÓW - ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep17BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep18BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep19BŁĄD PRZYPISÓW - ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep20BŁĄD PRZYPISÓW - ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep21BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep22BŁĄD PRZYPISÓW - ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep23BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep24BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep25BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep26BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep35BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep27BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep36BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep28BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep29BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep30BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep31BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep32BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep33BŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiep34BŁĄD PRZYPISÓW

