Lidhja dyfishe
Në kimi, një lidhje e dyfishtë ose dyfishe është një lidhje kovalente midis dy atomeve që përfshin katër elektrone lidhëse në krahasim me dy në një lidhje njëfishe . Lidhjet e dyfishta hasen më së shpeshti midis dy atomeve karbon, për shembull tek alkenet . Shumë lidhje të dyfishta ekzistojnë midis dy elementeve të ndryshëm: për shembull, në një grup karbonil midis një atomi karboni dhe një atomi oksigjeni. Lidhje të tjera të zakonshme të dyfishta gjenden në përbërjet azo (N=N), iminet (C=N) dhe sulfoksidet (S=O). Në një formulë skeletore, një lidhje e dyfishtë vizatohet si dy vija paralele (=) ndërmjet dy atomeve të lidhur; tipografikisht, për këtë përdoret shenja e barabartë . [1] [2] Lidhjet e dyfishta u prezantuan në shënimin kimik nga kimisti rus Aleksandër Butlerov . [ citim i nevojshëm ]
Lidhjet e dyfishta që përfshijnë karbonin janë më të forta dhe më të shkurtra se lidhjet njëfishe . Urdhri i detyrimit është dy. Lidhjet e dyfishta janë gjithashtu të pasura me elektrone, gjë që i bën ato potencialisht më reaktive në prani të një pranuesi të fortë elektroni (si në reagimet shtesë të halogjeneve ).
- Përbërjet kimike me lidhjet e dyfishta
-
Etileni - Lidhja e dyfishtë Karbon-Karbon
-
Aceton - Lidhja e dyfishtëKarbon-Oksigjen
-
Dimetil sulfoksid Squfur-Oksigjen
-
Diazen Azot-Azot
Lidhjet e dyfishta tek alkenet

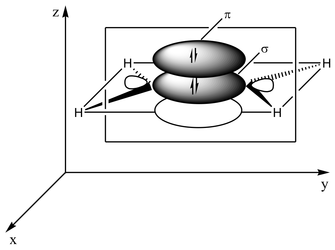
Lloji i lidhjes mund të shpjegohet në termat e hibridizimit orbital . Tek etileni, çdo atom karboni ka tre orbitale sp<sup id="mwSQ">2</sup> dhe një orbital p . Tre orbitalet sp2 shtrihen në një rrafsh me kënde ~ 120°. Orbitali p është pingul me këtë rrafsh. Kur atomet e karbonit afrohen me njëri-tjetrin, dy nga orbitalet sp2 mbivendosen për të formuar një lidhje sigma . Në të njëjtën kohë, dy orbitalet p afrohen (përsëri në të njëjtin rrafsh) dhe së bashku formojnë një lidhje pi . Për të patur mbivendosje maksimale, orbitalet p duhet të qëndrojnë paralele, dhe për këtë arsye, rrotullimi rreth lidhjes qendrore nuk është i mundur. Kjo veti krijon izomerizëm cis-trans . Lidhjet e dyfishta janë më të shkurtra se lidhjet e vetme sepse mbivendosja e orbitaleve p është maksimizuar.
-
2 orbitale sp2 (gjithsej 3 orbitale të tillë) afrohen për të formuar një lidhje sigma sp2-sp2
-
Dy orbitale p mbivendosen per te formuar nje lidhje pi ne nje plan paralel me rrafshin sigma
-
Lidhja pi(e gjelbër) tek etileni
Me 133 pm, gjatësia e lidhjes së etilenit C=C është më e shkurtër se gjatësia C − C tek etanin me 154 pm. Lidhja dyfishe është gjithashtu më e fortë, 636 kJ mol − 1 kundrejt 368 kJ mol − 1 por jo dy herë më shumë, sepse lidhja pi është më e dobët se lidhja sigma për shkak të mbivendosjes më pak efektive të pi.
- ^ March, Jerry, 1929-1997. (1985). Advanced organic chemistry : reactions, mechanisms, and structure (bot. 3rd). New York: Wiley. ISBN 0-471-88841-9. OCLC 10998226. Arkivuar nga origjinali më 2019-12-10. Marrë më 2020-12-12.
{{cite book}}: Mungon ose është bosh parametri|language=(Ndihmë!)Mirëmbajtja CS1: Emra shifrorë: lista e autorëve (lidhja) Mirëmbajtja CS1: Emra të shumëfishtë: lista e autorëve (lidhja) - ^ McMurry, John. Organic chemistry (bot. Ninth). Boston, MA, USA. ISBN 978-1-305-08048-5. OCLC 907259297. Arkivuar nga origjinali më 2024-04-04. Marrë më 2020-12-12.
{{cite book}}: Mungon ose është bosh parametri|language=(Ndihmë!)