Fosfora pentaoksido
| Fosfora pentaoksido | ||||
 | ||||
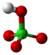
| Plata kemia strukturo de la Fosfora pentaoksido | ||||
 | ||||
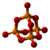
| Tridimensia kemia strukturo de la Fosfora pentaoksido | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 1314-56-3 | |||
| ChemSpider kodo | 14128 | |||
| PubChem-kodo | 14812 | |||
| Fizikaj proprecoj | ||||
| Aspekto | blanka senodora delikva solidaĵo | |||
| Molmaso | 283,885 g·mol−1 | |||
| Denseco | 2,39g cm−3 | |||
| Fandpunkto | 300 °C | |||
| Bolpunkto | 580 °C | |||
| Ekflama temperaturo | Nebrulema | |||
| Solvebleco | Akvo:reakcias | |||
| Mortiga dozo (LD50) | 1217 mg/kg (buŝe)[1] | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R35 R50 R51 [2] | |||
| Sekureco | S22 S26 S45 [3] | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H314, H318, H330 | |||
| GHS Deklaroj pri antaŭgardoj | P260, P264, P271, P280, P284, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P320, P321, P363, P403+233, P405, P501[4] | |||
(25 °C kaj 100 kPa) | ||||
Fosfora pentaoksido aŭ foje fosfora kvinoksido (molekula formulo P4O10) estas kemia kombinaĵo el fosforo, ankaŭ konata kiel fosfata anhidrido, blanka, senodora, delikva solidaĵo, uzata kiel potenca sekigaĵo kaj senhidratigagento. Ĝia nomo originas de sia minimuma formulo P2O5. Pro siaj senhidratigaj proprecoj, fosfora pentoksido estas alte koroda substanco, irita al okuloj, haŭto kaj mukozaj membranoj. Ĝi neniam fandiĝas kaj kiam temperaturo atinga 360 °C ĝi sublimiĝas. Ĝi facile sorbas humidecon, miksiĝas kun akvo formante fosfatan acidon.
Ĝia plej grava uzo estas por konvertado de primaraj aminoj en nitrilojn. Alternative, kiam kombinita kun karboksilata acido, la rezulto estas la responda anhidrido. Fosfora pentoksido ne estas brulema, sed tiel kiel sulfura trioksido, ĝi eksplode reakcias kun akvo aŭ akvo-enhavaj substancoj kiel ligno aŭ kotono liberigante multe da varmo kaj eĉ fajro.
Amonia valerato varmigita kun fosfora kvinoksido produktas valero-nitrilon.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Fosfora pentaoksido reakcias kun karbona monooksido:[5]
Reakcio 2
[redakti | redakti fonton]- Kvinoksido de fosforo reakcias kun nitrata acido por doni metafosfatan acidon:
Reakcio 3
[redakti | redakti fonton]- Pentaoksido de fosforo reakcias kun perklorata acido por doni metafosfatan acidon:
Reakcio 4
[redakti | redakti fonton]- Sintezo de fosforila klorido per interagado de fosfora kvinoksido kaj fosfora triklorido:
Reakcio 5
[redakti | redakti fonton]- Reakcio de pentaoksido de fosforo kun 2 molumoj da malvarma akvo:
Reakcio 6
[redakti | redakti fonton]- Reakcio de pentaoksido de fosforo kun 6 molumoj da malvarma akvo:
Literaturo
[redakti | redakti fonton]- American Elements
- Chemicalland21
- Science Lab Arkivigite je 2016-04-04 per la retarkivo Wayback Machine
- A Comprehensive Guide to the Hazardous Properties of Chemical Substances
- Sasol Encyclopaedia of Science and Technology
- The Chemistry of Phosphorus: Pergamon Texts in Inorganic Chemistry
Referencoj
[redakti | redakti fonton]- ↑ Fisher Scientific[rompita ligilo]
- ↑ Special Materials Company. Arkivita el la originalo je 2018-12-20. Alirita 2018-11-24 .
- ↑ Merck Millipore
- ↑ PubChem
- ↑ Bureau of Standards journal of research







![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](/media/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)
![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](/media/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)