Hexafluorpropylenoxid
(Weitergeleitet von Hexafluorpropenoxid)
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
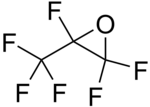
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexafluorpropylenoxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3F6O | |||||||||||||||
| Kurzbeschreibung |
farb- und fast geruchloses, nicht brennbares Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 166,02 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
6,91 g·cm−3 (0 °C)[1] | |||||||||||||||
| Siedepunkt |
−27 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Hexafluorpropylenoxid ist das Epoxid von Hexafluorpropen.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Hexafluorpropylenoxid kann durch Oxidation von Hexafluorpropen mit alkalischem Wasserstoffperoxid gewonnen werden.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Hexafluorproplyenoxid wird als Grundstoff für Perfluoralkoxy-Polymere sowie zur Herstellung von HFPO-DA eingesetzt.[3] Außerdem ist es Monomer für das Fluorpolymer Perfluorpolyether (Krytox).
Des Weiteren ist Hexafluorproplyenoxid in den meisten Synthesewegen von fluorierten Ionomeren beteiligt.[4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu Hexafluor-1,2-epoxypropan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Eintrag zu Trifluoro(trifluoromethyl)oxirane in der Hazardous Substances Data Bank (via PubChem), abgerufen am 15. März 2013.
- ↑ Wellington Reporter: Native and Mass-labelled Hexafluoropropylene Oxide Dimer Acid ( vom 16. Dezember 2013 im Internet Archive) (PDF; 104 kB), 20. Februar 2013.
- ↑ Walther Grot: Fluorinated Ionomers. William Andrew (heute Elsevier), 2011 (Volltext in der Google-Buchsuche).



