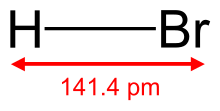
Hidrogen bromida
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
Hydrogen bromide[butuh rujukan] | |||
| Nama IUPAC (sistematis)
Bromane[1] | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Referensi Beilstein | 3587158 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
| MeSH | Hydrobromic+Acid | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
| Nomor UN | 1048 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| BrH | |||
| Massa molar | 80,91 g·mol−1 | ||
| Penampilan | Gas tak berwarna | ||
| Bau | Acrid | ||
| Densitas | 3.6452 kg/m3 (0 °C, 1013 mbar)[2] | ||
| Titik lebur | −869 °C (−1.532 °F; −596 K) | ||
| Titik didih | −668 °C (−1.170 °F; −395 K) | ||
| 221 g/100 mL (0 °C) 204 g/100 mL (15 °C) 193 g/100 mL (20 °C) 130 g/100 mL (100 °C) | |||
| Kelarutan | larut dalam alkohol dan pelarut organik | ||
| Tekanan uap | 2.308 MPa (at 21 °C) | ||
| Keasaman (pKa) | -8.8 (±0.8);[3] ~−9[4] | ||
| Kebasaan (pKb) | ~23 | ||
| Indeks bias (nD) | 1.325 | ||
| Struktur | |||
| Linear | |||
| 820 mD | |||
| Termokimia | |||
| Kapasitas kalor (C) | 350.7 mJ K−1 g−1 | ||
| Entropi molar standar (S |
198.696-198.704 J K−1 mol−1[5] | ||
| Entalpi pembentukan standar (ΔfH |
−36.45 – −36.13 kJ mol−1[5] | ||
| Bahaya | |||
| Lembar data keselamatan | hazard.com | ||
| Piktogram GHS |  
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H314, H335 | |||
| P261, P280, P305+351+338, P310 | |||
| Dosis atau konsentrasi letal (LD, LC): | |||
LC50 (konsentrasi median)
|
2858 ppm (rat, 1 hr) 814 ppm (mouse, 1 hr)[7] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
TWA 3 ppm (10 mg/m3)[6] | ||
REL (yang direkomendasikan)
|
TWA 3 ppm (10 mg/m3)[6] | ||
IDLH (langsung berbahaya)
|
30 ppm[6] | ||
| Senyawa terkait | |||
Senyawa terkait
|
Hidrogen fluorida Hidrogen klorida Hidrogen iodida Hidrogen astatida | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Hidrogen bromida adalah senyawa kimia dengan rumus HBr. Senyawa ini adalah cairan tak berwarna dan termasuk dalam hidrogen halida. Asam bromida adalah larutan HBr dalam air. Anhidrat dan larutan HBr adalah reagen umum dalam pembuatan senyawa bromida.
HBr sangat larut dalam air, membentuk larutan asam bromida, jenuh pada 68.85%wt HBr pada suhu kamar.
Penggunaan HBr
[sunting | sunting sumber]Hidrogen bromida dan asam bromida adalah reagen penting dalam produksi organik dan anorganik senyawa bromin.[8] Penambahan radikal bebas HBr ke alkena menghasilkan terminal alkil bromida:
- RCH=CH2 + HBr → RCH2–CH2Br
Agen alkilasi ini merupakan prekursor untuk turunan amina lemak. Penambahan radikal ke alil klorida serta stirena akan berturut-turut menghasilkan 1-bromo-3-kloropropana dan feniletilbromida.
Hidrogen bromida bereaksi dengan diklorometana menghasilkan bromoklorometana dan dibromometana, secara berurutan:
- HBr + CH2Cl2 → HCl + CH2BrCl
- HBr + CH2BrCl → HCl + CH2Br2
Alil bromida dibuat dengan mencampur alil alkohol dengan HBr:
- CH2=CHCH2OH + HBr → CH2=CHCH2Br + H2O
Reaksi lainnya
[sunting | sunting sumber]Meskipun tidak banyak digunakan industri, HBr ditambahkan ke alkena untuk menghasilkan bromoalkana, kelompok organobromina penting. Demikian pula, HBr ditambahkan ke haloalkena untuk membentuk geminal dihaloalkana. (Tipe adisi ini mengikuti aturan Markovnikov):
- RC(Br)=CH2 + HBr → RC(Br2)–CH3
HBr juga menambah alkuna untuk menghasilkan bromoalkena. Stereokimia dari tipe adisi ini biasanya anti:
- RC≡CH + HBr → RC(Br)=CH2
Juga, HBr digunakan untuk membuka epoksida dan lakton dan dalam sintesis bromoasetal. Selain itu, HBr mengkatalisis berbagai reaksi organik.[9][10][11][12]
Keselamatan
[sunting | sunting sumber]HBr sangat korosif dan menyebabkan iritasi jika terhirup.
Referensi
[sunting | sunting sumber]- ^ "Hydrobromic Acid - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 16 September 2004. Identification and Related Records. Diakses tanggal 10 November 2011.
- ^ Record dalam GESTIS Substance Database dari IFA
- ^ Trummal, A.; Lipping, L.; Kaljurand, I.; Koppel, I. A.; Leito, I. "Acidity of Strong Acids in Water and Dimethyl Sulfoxide" J. Phys. Chem. A. 2016, 120, 3663-3669. DOI:10.1021/acs.jpca.6b02253
- ^ Perrin, D. D. Dissociation constants of inorganic acids and bases in aqueous solution. Butterworths, London, 1969.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ISBN 0-618-94690-X.
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0331". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Hydrogen bromide". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Dagani, M. J.; Barda, H. J.; Benya, T. J.; Sanders, D. C. (2005), "Bromine Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a04_405 CS1 maint: Multiple names: authors list (link)
- ^ Hercouet, A.;LeCorre, M. (1988) Triphenylphosphonium bromide: A convenient and quantitative source of gaseous hydrogen bromide.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements; Butterworth-Heineman: Oxford, Great Britain; 1997; pp. 809-812.
- ^ Carlin, William W. U.S. Patent 4,147,601, April 3, 1979
- ^ Vollhardt, K. P. C.; Schore, N. E. Organic Chemistry: Structure and Function; 4th Ed.; W. H. Freeman and Company: New York, NY; 2003.


