Composé organophosphoré
Un composé organophosphoré est un type de composé organique comportant au moins un atome de phosphore. Les composés d'intérêt biologique tels l'ADN, d'une importance capitale notamment en biochimie, ne sont pas à proprement parler des composés organophosphorés : ils ne contiennent aucune liaison carbone-phosphore, et sont exclusivement des mono-, di- et triphosphates. Le Ténofovir est un organophosphoré proprement dit, alors que le désoxyadénosine monophosphate n'en est pas un.
Fruits d'une recherche sur les gaz de combat entamée lors de la Seconde Guerre mondiale, les pesticides organophosphorés, comme le malathion et le glyphosate, se sont substitués dans les années 1970 aux organochlorés, dont le chef de file, le DDT, faisait l'objet d'interdictions. Moins toxiques que le DDT et très efficaces, ils sont employés dans le monde entier.
Classes
[modifier | modifier le code]Les composés organophosphorés se répartissent en différentes classes selon le degré d'oxydation du phosphore et la nature des substituants, notamment la présence d'un atome d'oxygène ou d'un autre chalcogène.
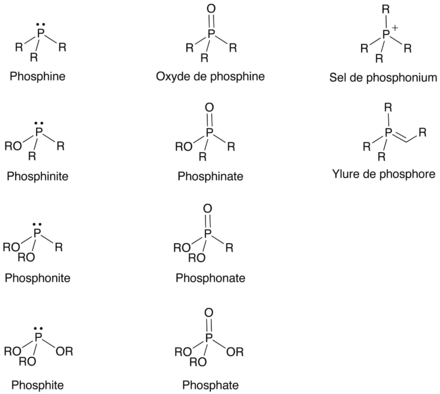
Composés organophosphorés comme analogues d'état de transition
[modifier | modifier le code]Généralités
[modifier | modifier le code]Les liaisons P–O sont environ 30 % plus longues que les liaisons C–O correspondantes. D'autre part, le phosphore V est plus ou moins tétraédrique, selon ses ligands. Finalement, un phosphate mime plutôt bien l'état de transition de l'hydrolyse d'un carboxylate en acide carboxylique. Cette particularité a été utilisée dans les plusieurs cas qui suivent.
Génération d'anticorps monoclonaux pour catalyser une réaction
[modifier | modifier le code]Si l'on souhaite catalyser une réaction chimique, on peut créer une molécule permettant d'abaisser l'énergie de l'état de transition, de la même façon que les enzymes le font. Pour cela, il faut créer un analogue stable de l'état de transition, l'injecter à un animal puis récolter un anticorps monoclonal efficace pour catalyser la réaction visée[réf. souhaitée]. L'idée sous-jacente est que l'anticorps généré contre l'analogue de l'état de transition doit aussi être efficace contre le véritable état de transition.
Gaz de combat et autres armes chimiques
[modifier | modifier le code]Des médicaments et des pesticides ont été créés à partir d'analogues d'état de transition organophosphorés. De la même manière, des produits chimiques dotés de caractéristiques qui vont perturber (gravement à mortellement) l'activité de certaines enzymes ont été produits en tant qu'agent de guerre chimique, notamment durant la guerre froide[1].
La plupart des gaz de combat et autres armes chimiques neurotoxiques sont basés sur l'inhibition d'enzymes vitales, comme l'acétylcholinestérase (AChE). L'acétylcholine sert de messager chimique entre deux neurones, ou entre un neurone et une fibre musculaire. Après la transmission du message par les molécules d'acétylcholine, l'acétylcholinestérase présente dans la jonction détruit les messagers chimiques qui sont ensuite récupérés et recyclés. Lorsque l'activité de l'acétylcholinestérase est perturbée, le signal chimique est maintenu ce qui peut créer une asphyxie par tétanisation des muscles, ou une crise d'épilepsie prolongée. Cette crise entraîne alors des lésions irréversibles des neurones (dues à un excès de calcium intracellulaire) ou la mort[1].
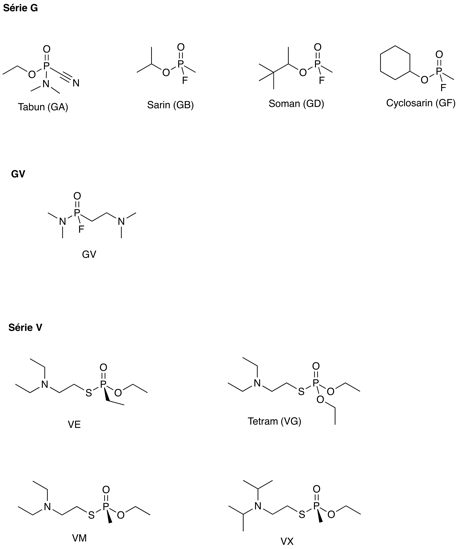
La série G, dont fait partie le sarin, était assez vite détruite par l'eau. Une « amélioration » (dans le sens militaire du terme) a été la série V, dont le fameux VX. Ces composés sont beaucoup plus résistants à l'eau et ils provoquent des lésions neurologiques irréversibles même si l'on injecte un antidote immédiatement après exposition. La plupart des articles scientifiques sur la chimie du phosphore jusque dans les années 1990 sont d'origine russe ; probablement en partie au moins en raison de la guerre froide.
L'Organisation pour l'interdiction des armes chimiques (OIAC), dans le cadre du traité de 1993, via le Conseil consultatif scientifique de l'Organisation pour l'interdiction des armes chimiques, a notamment travaillé[2] sur ces produits, avec un point publié en 2018 portant sur les soins médicaux et le prétraitements, soins d’urgence et traitements à long terme des lésions induites par certains agents neurotoxiques, sur la base de 140 études scientifiques afin d'apporter une synthèse d'informations mise à jour pour les professionnels de la santé (médecins, toxicologues, infirmiers, secouristes, etc.) ou écotoxicologues susceptibles d'intervenir en situation d’urgence, qui pourraient alors eux-mêmes être en danger et qui « risquent de ne pas connaître les symptômes et les options de traitement en cas d’exposition à des agents neurotoxiques »[1].
Toxicologie
[modifier | modifier le code]Comme dans la famille des carbamates, de nombreux organophosphorés sont des agents innervants, qui agissent principalement en inhibant l’acétylcholinestérase au niveau des jonctions neurales (inhibition qui devient irréversible après un temps variant selon la molécule et divers facteurs).
L'acétylcholine stagne alors en excès dans les synapses, ce qui est à l'origine d'un toxidrome cholinergique impliquant le système nerveux central (SNC), la jonction neuromusculaire et le système nerveux autonome[3],[4].
Les cas graves d'empoisonnement impliquent probablement aussi des récepteurs de l'acide γ-aminobutyrique et ceux du N-méthyl-d-aspartate, aggravant les effets toxiques du produit sur le SNC[3],[5],[6].
Trois types d'effets coexistent généralement :
- Effets muscariniques, dus à un surstimulation du système parasympathique : myosis (rétrécissement de la pupille) et vision floue ; sécrétions excessives et irrépressibles (hypersalivation, larmoiement, émission d'urine et défécation), crampes gastriques et vomissements (boue) ; bronchorrhée, bronchospasme et bradycardie[7] ;
- Effets nicotiniques, dus à une surstimulation des ganglions sympathiques (diaphorèse et tachycardie) et des jonctions entre neurones et muscle (⇒ fasciculation musculaire, faiblesse musculaire profonde et paralysie)[7] ;
- Spectre de dysfonctionnement du SNC : confusion, coma, apnée et convulsions. La mort est généralement due à une asphyxie induite par un trouble respiratoire de l'apnée centrale, un rétrécissement grave des voies respiratoires, une sécrétion pulmonaire excessive et à une paralysie des muscles respiratoires[7].
Le schéma (début, ordre et intensité) des effets cliniques varient selon l'agent, la dose, la voie d'exposition. Ainsi inhaler des nanoparticules ou vapeurs d'agent neurotoxique induit des symptômes oculaires, respiratoires et systémiques rapides (de quelques secondes à quelques minutes) suivis du déclenchement soudain de convulsions, d'une paralysie et d'un arrêt respiratoire[4].
Le passage percutané d'organophosphates produit des symptômes localisés précoces potentiels comme la diaphorèse et la fasciculation, suivis d'effets toxiques systémiques sur une période pouvant s'étendre à environ 48 heures après le moment de l'exposition[7].
Les effets toxiques des organophosphates sont pour partie les mêmes que ceux d'autres organophosphorés et des agents neurotoxiques de la grande famille des inhibiteur de la cholinestérase, avec quelques spécificités.
En cas d'ingestion de pesticide organophosphates, les symptômes apparaissent le plus souvent 30 à 90 minutes après l'ingestion, et ils persistent plusieurs jours si la personne survit.
Les convulsions sont plus rares qu'avec les agents innervants, mais un collapsus cardiovasculaire peut compliquer les empoisonnements aigus ainsi que des syndromes retardés dont un «syndrome intermédiaire» caractérisé par une faiblesse musculaire sévère impliquant une insuffisance respiratoire un à quatre jours après l'ingestion et une neuropathie périphérique[8].
En outre le pesticide étant souvent dilué dans un solvant pétrolier ce dernier peut induire des lésions pulmonaires liées à l'aspiration ou inhalation[8],[9].
Le pronostic dépend de la toxicité spécifique du produit, des antécédents de la victime, de la vitesse de diagnostic et de la réponse à l'antidote[8].
La toxicité des organophosphorées implique une chute des taux de cholinestérase sérique et érythrocytaire mais les tests de laboratoire de routine ou d'urgence pour les composés organophosphorés ne sont pas communément disponibles[7].
La protection (voire décontamination) du personnel et un équipement de protection individuelle sont nécessaires[8]. La décontamination gastro-intestinale est nécessaire en cas d'ingestion de pesticides[8]. Le traitement d'une intoxication se fait au moyen de soins de soutien méticuleux, avec une attention particulière pour le nettoyage des sécrétions des voies respiratoires, l'administration d'oxygène supplémentaire et une intubation endotrachéale précoce dans les cas graves. Ce protocole est complété par l'administration rapide d'antidote[7]. L'antidote principal est l'atropine (pour ses effets antimusciniques qui diminuent l'encombrement pulmonaire, la bronchoconstriction, l'hypotension, la bradycardie et potentiellement les convulsions[7], cependant les organophosphorés sont des poisons qui résistent aux doses habituelles d'atropine ; de « très fortes doses d'atropine peuvent être requises »[8],[7]. L'efficacité de la pralidoxime contre les effets de pesticides organophosphorés doit encore cependant être mieux démontrée, notamment dans les pays pauvres en ressources[7].
Réactions
[modifier | modifier le code]- Réaction de Michaelis-Arbuzov
- Réaction de Michaelis-Becker
- Réaction de Mitsunobu
- Réaction de Staudinger
- Réaction de Wittig
Détection
[modifier | modifier le code]Certains organophsophorés comptent parmi les neurotoxiques les plus puissants, il conviendrait donc de pouvoir les détecter, les identifier et doser facilement et rapidement[10].
Outre les moyens classiques, lents et couteux tels que chromatographie en phase gazeuse, chromatographie en phase liquide et spectrométrie de mobilité ionique) utilisées depuis plusieurs décennies pour la détection des organophosphorés et d'autres toxiques agrochimiques et de guerre (neurotoxiques, alvéolés, sanguins ou incapacitants), des moyens nouveaux sont à l'étude ou en cours de test, dont :
- la séparation immunomagnétique[11] ;
- des biocapteurs, qui pourraient bientôt surmonter les limitations des techniques de détection citées ci-dessus. Divers types de biocapteurs émergent, par exemple basés sur des nanotubes de carbone[12], des nanoparticules de zircon comme sorbants sélectifs[13], des nanostructures d'oxydes métalliques[14]). Le biocapteur idéal serait léger, donnerait un résultat immédiat de détection, sélectif (il désignerait précisément le gaz présent dans l'air et non une famille d'agents chimiques), simple d'utilisation, peu coûteux et répondrait aux exigences de la surveillance industrielle, de la protection civile et des militaires[15].
Notes et références
[modifier | modifier le code]- Timperley, C. M., Forman, J. E., Abdollahi, M., Al-Amri, A. S., Baulig, A., Benachour, D. … et Kane, W. (2019), Advice on assistance and protection provided by the Scientific Advisory Board of the Organisation for the Prohibition of Chemical Weapons: Part 1. On medical care and treatment of injuries from nerve agents, Toxicology, 415, 56-69 (résumé).
- À la suite de demandes émanant du directeur général de l’OIAC en 2013 et 2014 sur l’état des contre-mesures et traitements médicaux disponibles pour les agents neurotoxiques organophosphorés.
- King A.M. et Aaron C.K. (2015), Organophosphate and carbamate poisoning, Emerg. Med. Clin. North Am., 33:133-51.
- Sidell F.R., Newmark J. et McDonough J.H. (2018), Nerve agents, dans Tourinsky S.D., éd., Textbook of military medicine, Washington, DC, Department of the Army, 155-220, Ch5_pg155-220.pdf lire en ligne.
- Wiener S.W. et Hoffman R.S. (2004), Nerve agents: a comprehensive review, J. Intensive Care Med., 19:22-37.
- Worek F., Wille T., Koller M. et Thiermann H. (2016), Toxicology of organophosphorus compounds in view of an increasing terrorist threat, Arch. Toxicol., 90, 2131-45.
- Henretig F.M., Kirk M.A. et McKay Jr. (2019), Hazardous chemical emergencies and poisonings, New England Journal of Medicine, 380(17), 1638-1655.
- Eddleston M. (2015), Insecticides: organic phosphorus compounds and carbamates, dans Hoffman R.S., Howland M.A., Lewin N.A., Nelson L.S., Goldfrank L.R., éds., Goldfrank’s toxicologic emergencies, 10e éd., New York, McGraw-Hill, 1409-24.
- Eddleston M., Chowdhury F.R. (2016), Pharmacological treatment of organophosphorus insecticide poisoning: the old and the (possible) new, Br. J. Clin. Pharmacol., 81:462-70.
- Wang et al. (2001), Capillary electrophoresis microchips for separation and detection of organophosphate nerve agents, Anal. Chem., 73 (8), p. 1804-1808.
- J.L. Sporty et al. (2010), Immunomagnetic separation and quantification of butyrylcholinesterase nerve agent adducts in human serum, Anal. Chem., 82 (15), p. 6593-6600.
- Joshi K.A. et al. (2005), A disposable biosensor for organophosphorus nerve agents based on carbon nanotubes modified thick film strip electrode Electroanalysis, An. Int. J. Devoted Fundam. Asp. Pract. Electroanalysis, 17 (1), p. 54-58, ScopusGoogle Scholar.
- G. Liu et Y. Lin (2005), Electrochemical sensor for organophosphate pesticides and nerve agents using zirconia nanoparticles as selective sorbents, Anal. Chem., 77 (18), p. 5894-5901.
- Tomchenko A.A., Harmer G.P. et Marquis B.T. (2005), Detection of chemical warfare agents using nanostructured metal oxide sensors, Sens. Actuators B Chem., 108 (1–2), p. 41-55.
- Diauudin F. N. et al. (2019), A review of current advances in the detection of organophosphorus chemical warfare agents based biosensor approaches, Sensing and Bio-Sensing Research, 100305.
Articles connexes
[modifier | modifier le code]
| C-H | He | |||||||||||||||||
| C-Li | C-Be | C-B | C-C | C-N | C-O | C-F | Ne | |||||||||||
| C-Na | C-Mg | C-Al | C-Si | C-P | C-S | C-Cl | C-Ar | |||||||||||
| C-K | C-Ca | C-Sc | C-Ti | C-V | C-Cr | C-Mn | C-Fe | C-Co | C-Ni | C-Cu | C-Zn | C-Ga | C-Ge | C-As | C-Se | C-Br | C-Kr | |
| C-Rb | C-Sr | C-Y | C-Zr | C-Nb | C-Mo | C-Tc | C-Ru | C-Rh | C-Pd | C-Ag | C-Cd | C-In | C-Sn | C-Sb | C-Te | C-I | C-Xe | |
| C-Cs | C-Ba | * | C-Lu | C-Hf | C-Ta | C-W | C-Re | C-Os | C-Ir | C-Pt | C-Au | C-Hg | C-Tl | C-Pb | C-Bi | C-Po | C-At | Rn |
| Fr | C-Ra | * * |
Lr | Rf | Db | C-Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | C-La | C-Ce | C-Pr | C-Nd | C-Pm | C-Sm | C-Eu | C-Gd | C-Tb | C-Dy | C-Ho | C-Er | C-Tm | C-Yb | ||||
| * * |
Ac | C-Th | C-Pa | C-U | C-Np | C-Pu | C-Am | C-Cm | C-Bk | C-Cf | C-Es | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, peu d'usages courants | Liaison inconnue / non évaluée |
