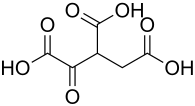
Oxalbernsteinsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Oxalbernsteinsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H6O7 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 190,1 g·mol−1 | ||||||||||||||||||
| Schmelzpunkt |
80,5 °C (Zersetzung)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Oxalbernsteinsäure ist der Trivialname einer organischen Tricarbonsäure, bzw. einer β-Ketocarbonsäure. Sie wurde 1948 gleichzeitig[3] von den Biochemikern Severo Ochoa und Feodor Lynen entdeckt.[4][1] Die freie Säure ist instabil und zerfällt zur Ketoverbindung, stabil sind dagegen ihre Salze, die Oxalsuccinate (auch Oxalosuccinate).
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Oxalbernsteinsäure bildet farblose, prismenförmige Kristalle, die bei 80,5 °C schmelzen. In der Schmelze erfolgt eine Zersetzung unter Abgabe von Kohlendioxid mit der Bildung von α-Ketoglutarsäure als Reaktionsprodukt.[1] Für Verbindung kann ein Keto-Enol-Gleichgewicht formuliert werden. Während im Feststoff ausschließlich die Ketoform vorliegt, können in Lösungen in organischen Lösungsmitteln wie Ethylacetat oder Diethylether bis zu 25 % der Substanz in der Enolform vorliegen.[5]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Die Oxalbernsteinsäure (beziehungsweise ihre Salze) ist ein Zwischenprodukt im Kohlenhydrat-Stoffwechsel sauerstoffverbrauchender Lebewesen. Bei dieser Stoffwechselfolge, dem Citratzyklus entsteht sie durch Oxidation aus Isocitronensäure. Durch Decarboxylierung wird sie in α-Ketoglutarsäure umgewandelt. Beide Schritte erfolgen, ohne dass sich das Substrat vom Enzym, der Isocitrat-Dehydrogenase, trennt. Dies (und damit auch die Entstehung von Oxalbernsteinsäure) wurde schon 1937 von Carl Martins postuliert.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Feodor Lynen, Helmut Scherer: Die Darstellung der Oxalbernsteinsäure und das Fermentsystem ihrer Decarboxylierung – Zum biologischen Abbau der Essigsäure V. In: Justus Liebigs Annalen der Chemie. 560, 1948, S. 163–190, doi:10.1002/jlac.19485600202.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von [No public or meaningful name is available] im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 26. Juli 2017.
- ↑ Hans Krebs: Vorlesung zur Verleihung des Nobelpreises, 11. Dezember 1953, S. 404. ( vom 6. November 2014 im Internet Archive)
- ↑ S. Ochoa: Biosynthesis of tricarboxylic acids by carbon dioxide fixation; the preparation and properties of oxalosuccinic acid. In: Journal of Biological Chemistry. Band 174, Nummer 1, Mai 1948, S. 115–122, PMID 18914069.
- ↑ Feodor Lynen, Hans Bayer, Helmut Holzer: Zur Desmotropie der Oxalbernsteinsäure in Justus Liebigs Annalen der Chemie 562 (1949) 66–73, doi:10.1002/jlac.19495620108.
- ↑ Carl Martins: Über den Abbau der Citronensäure. In: Hoppe-Seyler´s Zeitschrift für physiologische Chemie. 247, 1937, S. 104, doi:10.1515/bchm2.1937.247.3.104.

