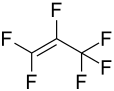
Hexafluorpropen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexafluorpropen | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C3F6 | |||||||||||||||
| Kurzbeschreibung |
farb- und fast geruchloses, nicht brennbares Gas[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 150,02 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
6,9145 kg·m−3 (0 °C, 1013 mbar)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−29,6 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,583 (−40 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Treibhauspotential |
< 1 (bezogen auf 100 Jahre)[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Hexafluorpropen (C3F6) ist die vollständig fluorierte Form des Propens. Das Molekül weist eine Doppelbindung zwischen den Kohlenstoffatomen auf.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Hexafluorpropen kann durch thermische Behandlung von Tetrafluorethen, Octafluorcyclobutan oder Chlortetrafluorethan sowie durch gemeinsame Pyrolyse von Chlordifluormethan und 2-Chlor-1,1,1,2-tetrafluorethan gewonnen werden.[7] Es tritt auch bei extremer thermischer Belastung von Polytetrafluorethylen (PTFE) aus.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das farblose Gas ist fast geruchlos. Hexafluorpropen reizt die Atemwege und ist gesundheitsschädlich beim Einatmen. Es besitzt eine kritische Temperatur von 86,2 °C, einen kritischen Druck von 55,0 bar und eine Tripelpunkt-Temperatur von −156,5 °C (Schmelztemperatur).[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Hexafluorpropen wird als Prozessgas in der Plasmatechnik eingesetzt, um PTFE ähnliche Schichten auf Oberflächen abzuscheiden. Es dient dabei als Comonomer für die technische Herstellung von Polymerisaten auf Basis von Tetrafluorethen (z. B. EFEP = Ethylen-TFE-HFP = Ethylen-Tetrafluorethylen-Hexafluorpropen).
Risikobewertung
[Bearbeiten | Quelltext bearbeiten]Hexafluorpropen wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Hexafluorpropen waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Stoffe. Die Neubewertung fand ab 2015 statt und wurde von Italien durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[9][10]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu PERFLUOROPROPYLENE in der CosIng-Datenbank der EU-Kommission, abgerufen am 20. November 2021.
- ↑ a b c d e f g h i j k Eintrag zu Hexafluorpropen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ E. Wilhelm, R. Battino, R.J. Wilcock: Low pressure solubility of gases in liquid water, Chemical Reviews 77 (2), S. 219–266 (1977).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-420.
- ↑ Eintrag zu Hexafluoropropene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- ↑ Patentanmeldung EP0337127A1: Verfahren zur Herstellung von Hexafluorpropen. Angemeldet am 11. März 1989, veröffentlicht am 18. Oktober 1989, Anmelder: Hoechst AG, Erfinder: Reinhold Freudenreich.
- ↑ Berliner Zeitung: Umweltrisiko Bratpfanne? 19. Juli 2001.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Hexafluoropropene, abgerufen am 6. März 2022.


