三硝基甲苯
| 三硝基甲苯 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 2,4,6-Trinitrotoluene 2,4,6-三硝基甲苯 | |||
| 别名 | 2-甲基-1,3,5-三硝基苯 棕色炸藥 | ||
| 识别 | |||
| 缩写 | TNT | ||
| CAS号 | 118-96-7 | ||
| PubChem | 8376 | ||
| ChemSpider | 8073 | ||
| SMILES |
| ||
| InChI |
| ||
| UN编号 | 0209 – Dry or wetted with < 30% water 0388, 0389 – Mixtures with trinitrobenzene, hexanitrostilbene | ||
| EINECS | 204-289-6 | ||
| RTECS | XU0175000 | ||
| DrugBank | DB01676 | ||
| KEGG | C16391 | ||
| 性质 | |||
| 化学式 | C7H5N3O6 | ||
| 摩尔质量 | 227.131 g·mol⁻¹ | ||
| 外观 | 棕色晶體,略帶黃色(久置顏色變深) | ||
| 密度 | 1.654 g/cm³[1] | ||
| 熔点 | 80.35 °C | ||
| 沸点 | 295 °C(分解) | ||
| 溶解性(水) | 130 mg/L, H2O (20 °C) | ||
| 溶解性 | 乙醚、丙酮、苯、吡啶 | ||
| 爆炸性 | |||
| 撞击感度 | 低 | ||
| 摩擦感度 | 353N 以下不敏感 | ||
| 爆速 | 6,900 m/s | ||
| 危险性 | |||
| 警示术语 | R:R2-R23/24/25-R33-R51/53 | ||
| 安全术语 | S:S35-S45-S61 | ||
| NFPA 704 | |||
| 相关物质 | |||
| 相关化学品 | 苦味酸(三硝基苯酚)、六硝基苯、三硝酸甘油酯 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
2,4,6-三硝基甲苯(英文:Trinitrotoluene,縮寫:TNT)常見炸藥之一,自發明至今廣泛應用在軍事和工業領域上。它的IUPAC命名是2,4,6-三硝基甲苯(2,4,6-trinitrotoluene),由甲苯經硝化製成,熔點為354 K(80.9°C)。呈棕色晶體狀(純品為幾乎無色的晶體)。易與苦味酸混淆,被誤稱為「黃色炸藥」[2]。和硝酸銨混合可成為阿馬托炸藥。
與硝化甘油不同,精煉的三硝基甲苯十分穩定,即使被槍擊,也不易爆炸。它需要雷管引爆。TNT不會與金屬起化學作用或者吸收水份。因此它可以存放多年。但它会與鹼強烈反應,生成不穩定的化合物。
TNT爆炸反應式:2C7H5N3O6 → 12CO + 5H2 + 3N2 + 2C
每克TNT炸藥可產生4200焦耳的能量(4.2MJ/kg)[3]。虽然三硝基甲苯的能量密度比脂肪(38MJ/kg)和糖(17MJ/kg)小,但它的分子中有三個硝基作为氧化劑,不需要大氣中的氧氣,所以引爆時會產生大量氣體,產生爆炸。現今有關爆炸和能量釋放的研究,也常常用「公斤TNT」或「噸TNT」作為單位,以比較爆炸、地震、行星撞擊等大型反應時所釋出的能量。
历史
[编辑]TNT由德国化学家朱利葉斯·威爾蘭德于1863年首次制备[4],最初被用作黄色染料。TNT作为炸药的潜在作用在30年内都未被发现,主要是因为它比其他替代品更不敏感,所以难以引爆。其爆炸特性由另一位德国化学家Carl Häussermann于1891年首次发现[5]。TNT在液体状态下可以被安全地注入弹壳中,而且由于非常不敏感,其不受英国《1875年爆炸物法案》(Explosives Act 1875)的约束,且在制造和储存时不被视为爆炸物[6]。
1902年,德军采用TNT作为大炮炮弹的填充物。使用TNT填充的穿甲弹在击穿英军主力舰的装甲后会爆炸,然而英军使用黃色炸藥填充的炮弹却往往会在撞击装甲时便爆炸,导致大部分能量在舰外便被消耗[6]。1907年,英军开始使用TNT取代黃色炸藥[7]。
在其他一些国家已经改用TNT后,美国海军仍继续使用D型炸药(苦味酸铵)填充穿甲弹,但已开始使用红糖色的粗制B级TNT炸药填充水雷、炸弹、深水炸弹和鱼雷弹头,其需要使用颗粒状结晶A级TNT的爆炸助推器来引爆。A级TNT也用于填充高爆弹,随着化学工业发展,在能从甲苯原料以及硝化反应产生的其他一硝基甲苯同分异构副产物中去除二甲苯及相似的烃后,TNT也成为其他用途的首选[8]。
-
块状的炸药级TNT
-
在81 °C(178 °F)下融化的TNT
-
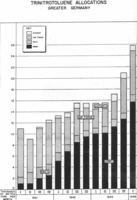
1941年至1944年第一季度,德军各部门TNT产量调查分析(单位为千吨每月)
毒性
[编辑]有些軍事試驗基地被TNT所污染。軍火所產生的污水會污染地面水和地下水。水被TNT和黑索金所污染後會呈粉紅色,這些污染物被稱為“粉紅水”[來源請求],清理程序十分困難和昂貴。
人長期暴露於三硝基甲苯會增加患貧血症和肝功能不正常的機會。注射了或吸入三硝基甲苯的動物亦發現會影響血液和肝臟、脾臟發大和其他有關免疫系統的壞影響。亦有證據證明了TNT對男性的生殖功能有不良影響[來源請求],而TNT也被列為一種可致癌物。進食TNT會使尿液變黑。能引起亚急性中毒、慢性中毒。例如引起白内障、中毒性肝炎,还会损坏造血系统。
合成
[编辑]可由甲苯经硝化制得。一次硝化法不经济,已经被淘汰。目前多采用三段硝化法。一段硝化中甲苯被硝化成一硝基甲苯(MNT),二段硝化中MNT被硝化成二硝基甲苯(DNT)。DNT也是重要的炸药。一、二段硝化只需浓度50%左右的硝酸溶液与硫酸混合作硝化剂。一段混酸的成份为HNO3 13%;H2SO4 66%;H2O 21%。甲苯混酸比约1:6。二段混酸成份为:HNO3 13%;H2SO4 76%; H2O 11%。MNT、混酸比为1:4~5。一二段硝化原料易得,工艺简单,制成的DNT成本低廉,很适于临时生产。第三段硝化是将DNT硝化为TNT,需要几乎不含水的混酸。一般是先向熔化了的DNT中加入发烟硫酸,再加入浓硝酸。发烟硫酸较缺乏的国家也使用浓硫酸。三段硝化的废酸可用于配制二段混酸,实现废物利用。第三段硝化难度较大,不适于临时生产。硝化后分离出的TNT为粗品,含大量杂质,须精制。目前常用的精制方法是亚硫酸钠法。
参考文献
[编辑]- ^ Record of CAS RN 118-96-7 in the GESTIS Substance Database from the IFA.
- ^ 軍事迷的盲區 黃色炸藥本非梯恩梯(TNT) ?!. 尖端科技 軍事資料庫. [2019-09-17]. (原始内容存档于2020-03-26).
- ^ Babrauskas, Vytenis. Ignition Handbook. Issaquah, WA: Fire Science Publishers/Society of Fire Protection Engineers. 2003: 453. ISBN 0-9728111-3-3.
- ^ Wilbrand, J. Notiz über Trinitrotoluol. Justus Liebigs Annalen der Chemie. 1863, 128 (2): 178–179 [2022-08-09]. doi:10.1002/jlac.18631280206. (原始内容存档于2022-07-12).
- ^ Peter O. K. Krehl. History of Shock Waves, Explosions and Impact: A Chronological and Biographical Reference. Springer Science & Business Media. 2008: 404 [2022-08-09]. ISBN 978-3-540-30421-0. (原始内容存档于2021-12-02).
- ^ 6.0 6.1 Brown GI. The Big Bang: a History of Explosives
 . Sutton Publishing. 1998: 151–153. ISBN 978-0-7509-1878-7.
. Sutton Publishing. 1998: 151–153. ISBN 978-0-7509-1878-7.
- ^ Norman Skentelbery. Arrows to Atom Bombs: A History of the Ordnance Board 2nd. Ordnance Board. 1975: 99 [2022-08-09]. (原始内容存档于2022-07-12).
- ^ Fairfield AP. Naval Ordnance. Lord Baltimore Press. 1921: 49–52.