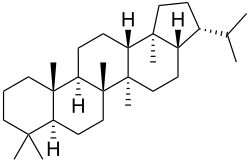
Triterpeno
Os triterpenos son unha clase de terpenos formados por seis unidades de isopreno (ou tres monoterpenos) coa fórmula C30H48. Os animais, as plantas e fungos producen triterpenos, como o escualeno, precursor de todos os esteroides.[1][2] Se os triterpenos conteñen oxíxeno e algúns grupos modificados reciben o nome de triterpenoides.
Estruturas
[editar | editar a fonte]Os triterpenos presentan unha gran variedade de estruturas. Identificáronse case 200 esqueletos diferentes de triterpenos.[3] Estes esqueletos poden ser clasificados segundo o número de aneis que presenten. En xeral as estruturas pentacíclicas (de 5 aneis) son as predominantes.
| Número de aneis | Exemplos |
|---|---|
| 0 | Escualeno |
| 1 | |
| 2 | Polipodatetraeno |
| 3 | Malabaricano |
| 4 | Lanostano, Cucurbitacina |
| 5 | Hopano, Oleanano, Ácido ursólico |
Triterpenoides
[editar | editar a fonte]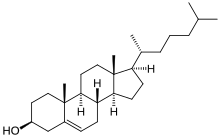
Por definición os triterpenos son hidrocarburos e non posúen heteroátomos (só teñen C e H); os triterpenos funcionalizados con outros átomos ou modificación de grupos químicos denomínanse triterpenoides. Non obstante, ás veces os dous termos utilízanse na literatura indistintamente.
Os triterpenoides posúen unha rica quimica e farmacoloxía (por exemplo, o colesterol) con varios motivos pentacíclicos. O lupano, oleanano e ursano parecen ser prometedores como axentes anticancerosos.[4][5]
Esteroides
[editar | editar a fonte]Os esteroides presentan un núcleo de cucurbitano, aínda que na práctica biosintetízanse a partir do lanosterol (en animais e fungos) ou do cicloartenol (en plantas) por medio da ciclacion do escualeno. Os esteroides teñen dúas funcións biolóxicas principais, son compoñentes clave das membranas celulares ou moléculas de sinalización que activan receptores de hormonas esteroides. Importantes subclases son os esterois e as cucurbitacinas.
Saponinas triterpenoides
[editar | editar a fonte]As saponinas triterpenoides son triterpenos que pertencen ao grupo de compostos da saponina, polo que son glicósidos triterpenoides. Prodúcenas as plantas como parte do seu mecanismo de autodefensa[6] con importantes subclases como os ginsenósidos (que aparecen no ginseng)[7] e eleuterósidos.
Os triterpenos biosintetízanse por condensación cabeza con cabeza de dúas unidades de farnesil pirofosfato (FPP) para formar escualeno. Á súa vez, o escualeno serve como precursor para a formación de triterpenoides, incluíndo os hopanoides bacterianos e os esterois eucariotas. O escualeno é un composto valioso en si mesmo, xa que se usa como antioxidante, e tamén en cosmetica, nutrición e vacinas. O escualeno é extraído do aceite de fígado de tiburón ou das olivas ou outras plantas oleaxinosas.[8][9]
Notas
[editar | editar a fonte]- ↑ Eberhard Breitmaier (2006). "Triterpenes". Terpenes: Flavors, Fragrances, Pharmaca, Pheromones. ISBN 9783527609949. doi:10.1002/9783527609949.ch6.
- ↑ Davis, Edward M.; Croteau, Rodney (2000). "Cyclization Enzymes in the Biosynthesis of Monoterpenes, Sesquiterpenes, and Diterpenes". Topics in Current Chemistry 209: 53–95. doi:10.1007/3-540-48146-X_2.
- ↑ Xu, Ran; Fazio, Gia C.; Matsuda, Seiichi P.T. (February 2004). "On the origins of triterpenoid skeletal diversity". Phytochemistry 65 (3): 261–291. doi:10.1016/j.phytochem.2003.11.014.
- ↑ Laszczyk, Melanie (2009). "Pentacyclic Triterpenes of the Lupane, Oleanane and Ursane Group as Tools in Cancer Therapy". Planta Medica 75 (15): 1549–60. PMID 19742422. doi:10.1055/s-0029-1186102.
- ↑ Liu, Jie (December 1995). "Pharmacology of oleanolic acid and ursolic acid". Journal of Ethnopharmacology 49 (2): 57–68. PMID 8847885. doi:10.1016/0378-8741(95)90032-2.
- ↑ Augustin, Jörg M.; Kuzina, Vera; Andersen, Sven B.; Bak, Søren (April 2011). "Molecular activities, biosynthesis and evolution of triterpenoid saponins". Phytochemistry 72 (6): 435–457. PMID 21333312. doi:10.1016/j.phytochem.2011.01.015.
- ↑ Attele, Anoja S; Wu, Ji An; Yuan, Chun-Su (December 1999). "Ginseng pharmacology". Biochemical Pharmacology 58 (11): 1685–1693. PMID 10571242. doi:10.1016/S0006-2952(99)00212-9.
- ↑ Huang ZR, Lin YK, Fang JY (January 2009). "Biological and pharmacological activities of squalene and related compounds: potential uses in cosmetic dermatology". Molecules 14 (1): 540–54. PMC 6253993. PMID 19169201. doi:10.3390/molecules14010540.
- ↑ Fox CB (September 2009). "Squalene emulsions for parenteral vaccine and drug delivery". Molecules 14 (9): 3286–312. PMC 6254918. PMID 19783926. doi:10.3390/molecules14093286.