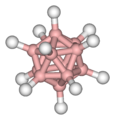
Borano


Los boranos son hidruros de boro, es decir, compuestos químicos formados exclusivamente por boro e hidrógeno. El más simple conocido es el BH3, aunque su masa molecular corresponde al diborano B2H6. La mayor parte de los boranos tienen fórmulas moléculares del tipo BnHn+4 o BnHn+6. Se obtienen por hidrólisis del boruro de magnesio con ácido clorhídrico diluido.
Algunos boranos típicos son B2H6, B4H10, B9H15, B10H14, B10H16. Los boranos se prepararon por primera vez entre 1912 y 1936 por Alfred Stock que desarrolló técnicas de vacío para manejar estas sustancias tan reactivas. La síntesis original de Stock, ‑la reacción del Mg3B2 con ácido‑, ha sido sustituida en la actualidad en todos los casos, excepto para el B6H10. La mayoría de las síntesis actuales implican la termólisis de B2H6 bajo condiciones diversas, con frecuencia en presencia de hidrógeno.
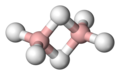
Diborano. El B2H6 es un gas (Tebullición=‑92.6°) inflamable espontáneamente en el aire y que se hidroliza instantáneamente por la acción del agua, formando H2 y B(OH)3. Se obtiene de manera prácticamente cuantitativa por la reacción estequiométrica del hidruro de litio con BF3.
El borano, BH3, tiene sólo una existencia momentánea en la descomposición térmica del diborano:
2B2H6 = BH3 + B3H9
El diborano tiene un gran número de reacciones. Como todos los compuestos BX3 puede actuar como un ácido Lewis y formar aductos tales como Me3NBH3; la formación del ion BH4- puede considerarse como una reacción con H‑.
Uno de los usos principales del B2H6 es como reactivo extremadamente versátil en la síntesis de organoboranos, que a su vez son productos intermedios muy útiles en síntesis orgánica. El B2H6 también es un agente reductor poderoso de algunos grupos funcionales, por ejemplo, RCHO ® RCH2 OH y RCN ® RCH2 NH2.
La reacción del B2H6 con hidrocarburos no saturados disueltos en éteres, denominada comúnmente hidroboración, da lugar a una cis‑hidrogenación o hidratación predominantemente anti‑Markovnikov.
Las carbonilaciones en las que se usa CO producen la formación de compuestos en los que el carbono "se inserta" entre el B y el C de un grupo alquilo.
Boranos superiores
Los boranos superiores, por ejemplo, B6H10, son principalmente líquidos cuya inflamabilidad en el aire decrece con el aumento de la masa molecular. Uno de los más importantes es el decaborano, B10H14, un sólido (Tfusión = 99.7° C) que es estable en el aire y sólo se hidroliza, lentamente, por la acción del agua. Se obtiene por calentamiento del B2H6 a 100° C y es un material de partida importante para la síntesis del anión B10H10 2- y de los carboranos.
Estructuras y enlace en los boranos
Las estructuras de los boranos son únicas y distintas a las de otros hidruros tales como los de carbono. Algunas de ellas se muestran formas parecidas a los arácnidos, de ahí la denominación de aracnoboranos. En ninguna de estas estructuras existen los electrones suficientes para permitir la formación de enlaces covalentes convencionales en las que se comparten un par de electrones entre átomos adyacentes (enlaces del tipo 2c‑2e). Surge así el problema de la deficiencia electrónica. Para racionalizar las estructuras de los boranos se desarrolló el primero de los diversos conceptos sobre el enlace policentrado. Este tipo de enlaces es deficiente en electrones, de tal manera que un solo par de electrones se encuentra deslocalizado entre tres átomos, de ahí que a veces se use el término tricentrado.
En la explicación de los puentes B‑H‑B para el más simple de los boranos, el diborano, se requieren enlaces del tipo 3c‑2e, (tres centros-dos electrones). Los enlaces B‑H terminales pueden considerarse como enlaces convencionales 2c‑2e. De este modo, cada átomo de boro emplea dos electrones y dos orbitales híbridos aproximadamente sp3 para formar enlaces 2c‑2e con los dos átomos de hidrógeno de los extremos. El átomo de boro de cada grupo BH2 aún posee un electrón y dos orbitales híbridos que puede emplear en enlaces posteriores. El plano de los dos orbitales restantes es perpendicular al plano BH2. Imaginemos que ahora esos dos grupos BH2 se aproximan entre sí en un movimiento de acercamiento hipotético, y que al mismo tiempo dos átomos de hidrógeno situados también por encima y por debajo del plano que forman los grupos BH2, se aproximan simultáneamente a los grupos BH2. En el plano de los cuatro orbitales vacíos correspondientes a cada grupo BH2, se formarán ahora dos enlaces B‑H‑B 3c-2e. El total de cuatro electrones que requieren estos dos nuevos enlaces tricentrados procede del electrón que posee cada átomo de H y de cada grupo BH2.
Acabamos de ver que en el B2H6 se utilizan dos elementos estructurales enlazados, esto es, grupos BH 2c‑2e y grupos BHB 3c‑2e. Para explicar las estructuras y enlace de los boranos superiores se necesitan estos elementos y otros tres más. Estos últimos son: grupos BB 2c‑2e, grupos BBB abiertos 3c‑2e y grupos BBB cerrados 3c‑2e. Estos cinco elementos estructurales enlazados se representan convenientemente del modo siguiente:
- enlace boro‑hidrógeno terminal 2c‑2e
- enlace por puente de hidrógeno 3c‑2e
- enlace boro‑boro 2c‑2e
- enlace por puente de boro abierto 3c‑2e
- enlace de boro cerrado 3c‑2e
Utilizando estos cinco elementos, William Lipscomb pudo desarrollar descripciones "semitopológicas" de, las estructuras y enlaces en todos los boranos. El esquema es susceptible de elaboración en un instrumento comprensivo y semipredictivo para correlacionar todos los datos estructurales.
El esquema semitopológico no siempre proporciona la mejor descripción del enlace en los boranos y especies relacionadas con ellos, como boranos poliédricos aniónicos y carboranos que se estudian después. Cuando existe simetría de alto orden, con frecuencia, es mejor pensar en términos de una descripción por orbitales moleculares, (O.M.) de enlaces fuertemente deslocalizados. Por ejemplo, en el B5H9, los cuatro átomos de boro basales están relacionados de manera equivalente con el átomo de boro del vértice. Es posible describir un híbrido en resonancia que abarque los elementos pero resulta más simple y elegante formular una serie de siete O.M. pentacentrados con los tres orbitales más bajos en energía ocupados por pares electrónicos. Cuando se tratan especies hipersimétricas como el B12H12 2‑, el uso de la simetría molecular completa en un tratamiento basado en la descripción por O.M. llega a ser el único medio práctico y riguroso.
Acidez de los boranos
Los boranos son ácidos de Lewis (es decir, aceptan pares de electrones de otros compuestos). La acidez está relacionada con el tamaño de la molécula, debido a que estos enlaces son deficientes en electrones. A mayor tamaño de la molécula, mayor deslocalización de los electrones. Por tanto los enlaces serán más débiles y, en consecuencia, tendrán más facilidad para ceder protones.
Reactividad
Una motivación aún mayor para el estudio teórico de las estructuras electrónicas de estas moléculas es la comprensión de su reactividad química. Uno de los tipos más importantes de reacción que experimentan los boranos (y también los aniones borano y carboranos) es la sustitución electrofílica. Aquellos átomos de boro a los que la teoría de enlace asigna la carga negativa mayor son los atacados preferencialmente en la sustitución electrofílica. Por ejemplo, en el B10H14, las distribuciones de carga, calculadas por tratamientos de O.M., asignan un exceso considerable de carga negativa (~ 0.25e) a los átomos de boro 2 y 4, una neutralidad aproximada a los 1 y 3 y carga positiva a los restantes. Consecuentemente, los experimentos muestran que sólo pueden sustituirse electrofílicamente las posiciones 1, 2, 3 y 4 y que las 2 y 4 son quizá ligeramente preferidas. Se ha obtenido un acuerdo similar entre los resultados experimentales y las distribuciones de carga calculadas para el carborano B10C2H12.
Referencias
- Boscke, F., ed., New Results in Boron Chemistry, Fortschritte der Chemischen Forschung, Springer Verlag, 1971.
- Brown, H. C., Boranes in Organic Chemistry, Comell University Press, 1972.
- Grimes, R. N., Carboranes, Academic Press, 1971.
- Muetterties, E. L., ed., The Chemistry of Boron and its Compounds, Wiley, 1967.
- Muetterties, E. L. y Knoth, W. H., Polyhedral Boranes, Dekker, 1968.

![Pentaborano-[9], B5H9](/media/wikipedia/commons/thumb/1/19/Pentaborane-3D-balls.png/120px-Pentaborane-3D-balls.png)
![Decaborano-[14], B10H14](/media/wikipedia/commons/thumb/d/d3/Decaborane-3D-balls.png/120px-Decaborane-3D-balls.png)