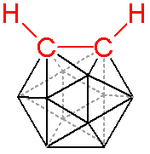
Carborano


Esquema de color:
hidrógeno − blanco,
cloro − verde,
boro − rosa,
carbono − negro.
Un carborano es un clúster compuesto por átomos de hidrógeno, boro y carbono. Estos clústers son poliédricos como lo son los boranos, unos compuestos relacionados con los carboranos, y pueden clasificarse de manera similar a éstos con los prefijos closo-, nido-, aracno-, hifo-, etc. según si presentan un poliedro completo (closo-) o un poliedro al que le faltan uno (nido-), dos (aracno-), tres (hifo-) o más vértices.
Ejemplos interesantes de carboranos son los extremadamente estables closo - carboranos icosaédricos.[1]
Un ejemplo importante es el C2B10H12 de carga neutra denominado o-carborano (de orto-carborano), del que se han estudiado sus posibles aplicaciones como polímero de alta resistencia al calor o con fines médicos. Se trata de un compuesto super - aromático ya que obedece a la regla de Hückel y muestra una alta estabilidad térmica. A 420 °C, el o-carborano se transforma en su isómero meta. En comparación, el benceno requiere una temperatura superior a los 1000 °C para inducir el reordenamiento estructural. Al igual que los arenos (es decir, hidrocarburos aromáticos), los carboranos son susceptibles de sufrir sustitución electrófila aromática.
Otro carborano importante es el CHB11H12—, con carga neta negativa, que se emplea para obtener superácidos sólidos. El carborano superácido H(CHB11Cl11)[2] es aproximadamente un millón de veces más fuerte que el ácido sulfúrico. La razón de esta elevada acidez es que el anión CHB11Cl11— es muy estable y posee sustituyentes electronegativos. H(CHB11Cl11) es el único ácido conocido capaz de protonar el fulereno C60 sin descomponerlo.[3][4]
Dicarbadodecarborano
[editar]El carborano más pesado que ha sido estudiado es el C2B10H12 (punto de fusión = 320 °C). Se suele sintetizar haciendo reaccionar acetileno con decaborano. Una variante de este método conlleva el uso de acetilenodicarboxilato de dimetilo para dar C2B10H10(CO2C H3)2, que puede degradarse a C2B10H12.[5]
Historia
[editar]Los 1,2-closo-dicarbadodecarboranos (normalmente conocidos simplemente como carboranos) fueron dados a conocer simultáneamente por dos grupos en la Olin Corporation y en la Reaction Motors Division of Thiokol Chemical Corporation trabajando para las fuerzas aéreas de los Estados Unidos de América, y publicados en 1963.[6][7][8][9][10][11][12][13][14] Al mismo tiempo, un grupo de la Unión Soviética publicó un trabajo similar. Hasta entonces se pensaba que los derivados del decaborano serían térmicamente inestables y reactivos frente al agua y el aire. Estos grupos demostraron la estabilidad sin precedentes del grupo de los 1,2 -closo-dodecaboranos, presentaron un método de síntesis general, describieron cómo cambiar los sustituyentes sin destruir el clúster y además demostraron la isomerización de la forma orto a la forma meta.
Dicarballuro
[editar]Se han efectuado numerosos estudios sobre derivados del llamado anión dicarballuro. [B9C2H11]2-. Este anión forma compuestos sándwich con muchos metales de transición, silicio y galio, algunos de los cuales puede encontrarse en estados de oxidación poco usuales (altos). El dianión es un clúster de tipo nido preparado por degradación del dicarborano correspondiente:[15]
- B10C2H12 + 3 CH3OH + KOH → KB9C2H12 + B(OCH3)3 + H2O + H2
1,2-dehidro-o-carborano
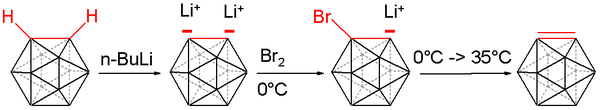
[editar]El 1,2-dehidro-o-carborano o carborino es un derivado inestable del orto-carborano de fórmula B10C2H10. En este derivado los hidrógenos sustituyentes en el C2 no están presentes. El compuesto es semejante e isolobular al bencino.[16][17][18] Esta especie química fue sintetizada por primera vez en 1990 a partir del o-carborano. Los átomos de hidrógeno unidos al carbono fueron eliminados utilizando N-butil-litio en tetrahidrofurano. El dianión de litio resultante se hizo reaccionar con bromo a 0 °C para formar el monoanión de bromo.
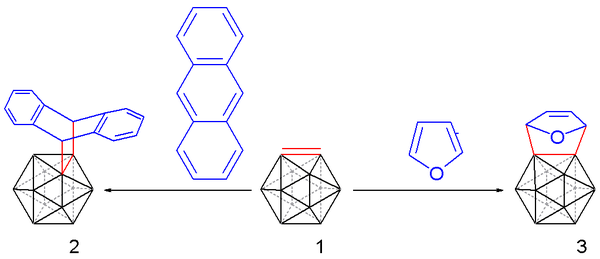
Calentando la mezcla de reacción hasta los 35 °C se libera el 1,2-dehidro-o-carborano, que puede ser "atrapado" con un dieno apropiado:
tal como el antraceno (para originar una molécula de estructura tipo tripticeno [2]), o el furano [1] con un rendimiento de entre el 10 % y el 25 %.
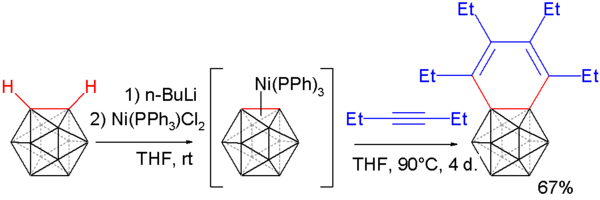
El 1,2-dehidro-o-carborano reacciona con alquinos para formar benzocarboranos[19][20] en una adaptación del procedimiento descrito anteriormente. El o-carborano se desprotona con N-butil-litio como en el caso anterior y después se le hace reaccionar con dicloruro de (trifenilfosfina)níquel originando un compuesto de coordinación con níquel. Este compuesto reacciona con el 3-hexino en un proceso de trimerización para dar el benzocarborano.
EL análisis por difracción de rayos X de cristal único de este compuesto muestra una considerable variación en la distancia de enlace en el anillo bencénico (desde 164,8 pm hasta 133, 8 pm), con la subsisguiente pérdida de aromaticidad.
Referencias
[editar]- ↑ Eluvathingal D. Jemmis (1982). «Overlap control and stability of polyhedral molecules. Closo-Carboranes». J. Am. Chem. Soc. 104: 7017-7020. doi:10.1021/ja00389a021.
- ↑ Nótese en la imagen que el protón ácido no es el que está unido al carborano, sino el contraión que no está representado en la imagen
- ↑ Mark Juhasz, Stephan Hoffmann, Evgenii Stoyanov, Kee-Chan Kim, Christopher A. Reed (2004). «The Strongest Isolable Acid». Angewandte Chemie International Edition (Communication) 43: 5352 - 5355. doi:10.1002/anie.200460005.
- ↑ Christopher A. Reed. «Carborane acids. New "strong yet gentle" acids for organic and inorganic chemistry» (Full article (reprint)). Chem. Commun. 2005: 1669-1677. doi:10.1039/b415425h. Archivado desde el original el 11 de mayo de 2020. Consultado el 17 de febrero de 2008.
- ↑ Kutal, C. R.; Owen, D. A.; Todd, L. J. (1968). «Closo-1,2-dicarbadodecaborane(12)». Inorganic Syntheses 11: 19-23.
- ↑ T. L. Heying, J. W. Ager, S. L. Clark, D. J. Mangold, H. L. Goldstein, M. Hillman, R. J. Polak, and J. W. Szymanski (1963). «A New Series of Organoboranes. I. Carboranes from the Reaction of Decaborane with Acetylenic Compounds». Inorganic Chemistry 2: 1089 - 1092. doi:10.1021/ic50010a002.
- ↑ H. Schroeder, T. L. Heying, J. R. Reiner (1963). «A New Series of Organoboranes. II. The Chlorination of 1,2-Dicarbaclosododecaborane(12)"». Inorganic Chemistry 2: 1092 - 1096. doi:10.1021/ic50010a003.
- ↑ T. L. Heying, J. W. Ager, S. L. Clark, R. P. Alexander, S. Papetti, J. A. Reid, S. I. Trotz (1963). «A New Series of Organoboranes. III. Some Reactions of 1,2-Dicarbaclosododecaborane(12) and its Derivatives». Inorganic Chemistry 2: 1097 - 1105. doi:10.1021/ic50010a004.
- ↑ S. Papetti, T. L. Heying (1963). «A New Series of Organoboranes. IV. The Participation of the 1,2-Dicarbaclosododecaborane(12) Nucleus in Some Novel Heteratomic Ring Systems». Inorg. Chem. 2: 1105-1107. doi:10.1021/ic50010a005.
- ↑ M. M. Fein, J. Bobinski, N. Mayes, N. Schwartz, M. S. Cohen (1963). «Carboranes. I. The Preparation and Chemistry of 1-Isopropenylcarborane and its Derivatives (a New Family of Stable Closoboranes)». Inorg. Chem. 2: 1111 - 1115. doi:10.1021/ic50010a007.
- ↑ M. M. Fein, D. Grafstein, J. E. Paustian, J. Bobinski, B. M. Lichstein, N. Mayes, N. N. Schwartz, M. S. Cohen (1963). «Carboranes. II. The Preparation of 1- and 1,2-Substituted Carboranes». Inorg. Chem. 2: 1115 - 1119. doi:10.1021/ic50010a008.
- ↑ D. Grafstein, J. Bobinski, J. Dvorak, H. Smith, N. Schwartz, M. S. Cohen, M. M. Fein (1963). «Carboranes. III. Reactions of the Carboranes». Inorg. Chem. 2: 1120 - 1125. doi:10.1021/ic50010a009.
- ↑ D. Grafstein, J. Bobinski, J. Dvorak, J. E. Paustian, H. F. Smith, S. Karlan, C. Vogel, M. M. Fein (1963). «Carboranes. IV. Chemistry of Bis-(1-carboranylalkyl) Ethers». Inorg. Chem. 2: 1125 - 1128. doi:10.1021/ic50010a010..
- ↑ D. Grafstein, J. Dvorak (1963). «Neocarboranes, a New Family of Stable Organoboranes Isomeric with the Carboranes». Inorg. Chem. 2: 1128 - 1133. doi:10.1021/ic50010a011.
- ↑ Plešek, J.; Heřmánek, S.; Štíbr, B. Inorganic Syntheses, 1983, volumen 22, páginas 231-124.
- ↑ Henry L. Gingrich, Tirthankar Ghosh, Qiurong Huang, and Maitland Jones (1990). «1,2-Dehydro-o-carborane». J. Am. Chem. Soc. 112 (10): 4082 - 4083. doi:10.1021/ja00166a080.
- ↑ E. D. Jemmis and B. Kiran (1997). «Structure and Bonding in B10X2H10 (X = C and Si). The Kinky Surface of 1,2-Dehydro-o-Disilaborane». J. Am. Chem. Soc. (19): 4076-4077. doi:10.1021/ja964385q.
- ↑ B. Kiran, A. Anoop, E. D. Jemmis (2002). «Control of Stability through Overlap Matching: closo-Carboranes and closo-Silaboranes». J. Am. Chem. Soc. 124: 4402-4407. doi:10.1021/ja016843n.
- ↑ Liang Deng, Hoi-Shan Chan, and Zuowei Xie (2006). «Nickel-Mediated Regioselective [2 + 2 + 2] Cycloaddition of Carboryne with Alkynes». J. Am. Chem. Soc. 128 (24): 7728 - 7729. doi:10.1021/ja061605j.
- ↑ Eluvathingal D Jemmis and Anakuthil Anoop (2004). «Theoretical Study of the Insertion Reactions of Benzyne- and Carboryne- Ni Complexes». MHPCC Application Briefs: 51. Archivado desde el original el 13 de julio de 2006.
Enlaces externos
[editar]- (en inglés) The Reed Group Archivado el 18 de diciembre de 2015 en Wayback Machine.
- (en inglés) Ficha de datos de seguridad (FDS)