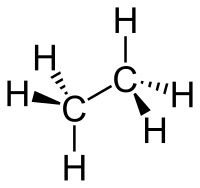
Ethan
| Ethan | |
|---|---|
| |
| Systemateschen Numm (IUPAC) | Ethan |
| Trivialen Numm | Ethan |
| Chemesch Formel | C2H6 |
| Ausgesinn | duerchsiichtege Gas[1] |
| Eegenschaften | |
| Dicht | 1.0493 bei 0 °C[1] |
| Léislechkeet am Waasser | 0,0602 (bei 25 °C am Waasser)[1] g·L−1 |
| Molmass | 30,07 g·mol−1 |
| Schmëlzpunkt | -172[1] °C |
| Kachpunkt | -88[1] °C |
| Thermodynamesch Daten | |
| Standard Formatiounsenthalpie ΔfH0Gas
|
-84.67 ± 0.49[2] kJ·mol−1 |
| Standardentropie S0Gas
|
230[3] J·K−1·mol−1 |
|
Verbrennungsenthalpie ΔcH0Gas
|
-1559.9 ± 0.46[2] kJ·mol−1 |
| Weideres | |
| Ähnlech Moleküllen | Methan Propan Butan |
| Chemesch Famill | Alkanen |
Ethan ass e gesiedegten Kuelewaasserstoff aus der Famill vun den Alkanen. E kënnt am Sumpfgas, Äerdgas an an de Raffinerie- a Kokereigaser vir. Ethan ass e Bestanddeel vun de Brenngaser.
Physikalesch Esgenschaften
Ethan ass bei 25 °C an 1013 hPa am gasfërmege Zoustand an en huet kee Geroch[1] a keng Faarf[1]. En ass bësse méi schwéier wéi Loft, seng Dicht läit bei 1,05[1][4]. Ethan léist sech schlecht am Waasser op, dofir awer ass en am Benzol gutt léislech. Wéi de Methan, ass och den Ethan schwéier ze verflëssegen, wéinst sengem nidderege Kachpunkt.[4]
Chemesch Eegenschaften
Ethan ass liichtentzündlech a kann, mat Sauerstoff gemëscht, explodéieren. E brennt mat enger schwacher Flam. Bei der Verbrennung vum Ethan entsteet, wéi bei all Alkan, Waasser a Kuelendioxid[5].
Ethan forméiert mam Chlor a mam Brom duerch Substitutioun nei Produiten. Déi wichtest sinn déi chloréiert Substitutiounsproduiten wéi de Monochloroethan, den Dichloroethan, den Trichloroethan, den Tetrachloroethan, de Pentachloroethan a den Hexachloroethan[5].
Produktioun vum Ethan
Am Laboratoire:
Ethan kann ee mat der Elektrolys vun enger konzentréierter Natriumacetat-Léisung hirstellen. Dobäi entsteet un der Kathod Waasserstoff an un der Anod Ethan a Kuelendioxid.
Eng aner Méiglechkeet ass d’Wurtz-Reaktioun. Mat Monochloromethan a Natrium léisst sech Ethan gutt hierstellen[5].
Eng drëtt Method besteet doranner, Natriumpropanoat mat Natriumhydroxid ze hëtzen[5].
An der Industrie:
Aus Äerdgas kann e Ethan industriell hirstellen. Aner Methode sinn d’Pëtrolhydréierung an d’Kuelenhydréierung.
Uwendung
An der chemescher Industrie gëtt Ethan geholl fir Ethen hirzestellen. Eng Method dofir ass de Cracking. Bei 500 °C bis 1000 °C gëtt den Ethan an Ethen a Waasserstoff ëmgewandelt[5][4].
Literatur
- Éditions A. De Boeck, Bruxelles, 1979, Chimie organique, A. Dessart - J. Jodogne - J. Paul
Um Spaweck
Referenzen
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 O'Neil, M. J. (ed.). The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. 13th Edition, Whitehouse Station, NJ: Merck and Co., Inc., 2001., p.664
- ↑ 2,0 2,1 Prosen, E.J.; Rossini, F.D., Heats of combustion and formation of the paraffin hydrocarbons at 25° C, J. Res. NBS, 1945, 263-267.
- ↑ J. G. Stark, H. G. Wallace, Chemistry Data Book, Second Edotion in SI, London: John Murray, 1982, p. 48
- ↑ 4,0 4,1 4,2 http://www.seilnacht.com/Chemie/ch_ethan.htm [16.02.2012]
- ↑ 5,0 5,1 5,2 5,3 5,4 Éditions A. De Boeck, Bruxelles, 1979, Chimie organique, A. Dessart - J. Jodogne - J. Paul, S.64-65
| Commons: Ethane – Biller, Videoen oder Audiodateien |



