Ethan
| Ethan | |
|---|---|
| |
| Systemateschen Numm (IUPAC) | Ethan |
| Trivialen Numm | Äthan |
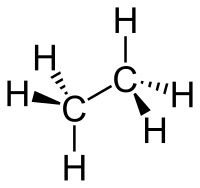
| Cheemesch Formel | C2H6 |
| Ausgesinn / Geroch | Faarflose, gerochlose Gas |
| Eegenschaften | |
| Dicht | 1,36 g/l bei 0 °C, 1013 hPa |
| Léislechkeet | 0,0602 g/l (bei 25 °C am Waasser) |
| Agregatzoustand | gasfërmeg |
| Molmass | 30,07 g/mol |
| Schmëlzpunkt | -183 °C |
| Kachpunkt | -89 °C |
| Thermodynamesch Daten | |
| Standard Formatiounsenthalpie ΔfH0
|
-84 KJ·mol−1 |
| Standardentropie S0
|
230 J·K−1·mol−1 |
| Verbrennungsenthalpie ΔcH0
|
-1560,7 KJ·mol−1 |
| Weideres | |
Ethan (oder Äthan) ass e gesiedegte Kuelewaasserstoff aus der Famill vun den Alkanen. E kënnt am Sumpfgas, Äerdgas an an de Raffinerie- a Kokereigaser vir. Ethan ass e Bestanddeel vun de Brenngaser.
Physikalesch Eegeschaften
Ethan ass bei 25 °C an 1013 hPa am gasfërmegen Zoustand an en huet kee Geroch a keng Faarf. En ass méi schwéier wéi Loft, seng Dicht läit bei 1,36 g/l. Ethan léist sech schlecht am Waasser, dofir awer ass en am Benzol gutt léislech. Wéi de Methan, ass och den Ethan schwéier ze verflëssegen, wéinst sengem nidderege Kachpunkt.
Chemesch Eegeschaften
Ethan ass liicht brennbar a kann, mat Sauerstoff gemëscht, explodéieren. E brennt mat enger schwacher Flam. Bei der Verbrennung vum Ethan entsteet, wéi bei all Alkan, Waasser a Kuelendioxid[1].
Ethan forméiert mat Chlor a mat Brom duerch Substitutioun nei Produkten. Déi wichtegst sinn déi chloréiert Substitutiounsprodukten wéi de Monochlorethan, den Dichlorethan, den Trichlorethan, den Tetrachlorethan, de Pentachlorethan a den Hexachlorethan.
Produktioun vum Ethan
Am Laboratoire:
Ethan kann een duerch Elektrolys vun enger konzentréierter Natriumacetat-Léisung hirstellen. Dobäi entsteet un der Kathod Waasserstoff an un der Anod Ethan a Kuelendioxid.
Eng aner Méiglechkeet ass d’Wurtz-Reaktioun. Mat Monochloromethan a Natrium léisst sech Ethan gutt hierstellen[1].
Eng drëtt Method besteet doran, Natriumpropanoat mat Natriumhydroxid ze hëtzen.
An der Industrie: Aus Äerdgas kann een Ethan industriell hirstellen. Aner Methode sinn d’Pëtrolhydréierung an d’Kuelenhydréierung.
Uwendung
An der chemescher Industrie gëtt Ethan benotzt fir Ethen hirzestellen. Eng Method dofir ass de Cracking. Bei 500 °C bis 1000 °C gëtt den Ethan an Ethen a Waasserstoff ëmgewandelt.
Literatur
- Éditions A. De Boeck, Bruxelles, 1979, Chimie organique, A. Dessart - J. Jodogne - J. Paul
Um Spaweck
| Commons: Ethane – Biller, Videoen oder Audiodateien |
- http://www.seilnacht.com/Chemie/ch_ethan.htm
- http://webbook.nist.gov/cgi/cbook.cgi?Name=ethane&Units=SI [28.02.2012]



