α-シヌクレイン
α-シヌクレイン (あるふぁ-しぬくれいん) はSNCA 遺伝子によってエンコードされるアミノ酸140残基からなるタンパク質[5][6][7]。
このタンパクの断片が、アルツハイマー病に蓄積するアミロイド中の (主な構成成分であるアミロイドベータとは別の) 成分として発見され、もとのタンパク質がNACP (Non-Abeta component precursor 非アミロイド成分の前駆体) と命名された。後にこれがシビレエイ属のシヌクレインタンパクと相同であることがわかり、ヒトα-シヌクレインと呼ばれるようになった。
α-シヌクレインの蓄積は、パーキンソン病をはじめとする神経変性疾患 (いわゆるシヌクレイノパチー) の原因とされている[8][9]。
組織発現
[編集]α-シヌクレインは主として神経組織内にみられる機能不明のタンパク質であり、細胞質中のタンパク質の約1%にのぼる[10]。α-シヌクレインは主に大脳新皮質、海馬、黒質、視床および小脳に発現する。主として神経細胞内に存在するが、グリア細胞内でも見られる[11]。メラニン細胞では、SNCA遺伝子の発現を小眼球症関連転写因子 (microphthalmia-associated transcription factor, MITF) が調節している可能性がある[12]。
α-シヌクレインが哺乳類の神経細胞体の核周辺にも広く存在していることがわかっており、このタンパク質が核内で何らかの役割を果たしている可能性が考えられる[13]。しかしむしろシナプス前終末で圧倒的に多くみられ、脂質二重膜に結合しあるいは細胞質中に遊離して存在するが[14][15]、膜結合型のものは約15%程度にすぎない[16]。
α-シヌクレインは神経細胞のミトコンドリア内部に局在することが明らかになってきた[17]。嗅球、海馬、線条体、黒質、視床では細胞質・ミトコンドリア内部にともに高濃度のα-シヌクレインが存在するが、一方大脳皮質と小脳では細胞質には豊富に存在するもののミトコンドリア内部には少ない、あるいはほとんど存在しない[18]。ミトコンドリア内部のα-シヌクレインが、内膜上に局在していること、そして濃度依存的にミトコンドリア呼吸鎖の複合体Iに対して阻害的に作用することもわかっている。これらのことから、もともとミトコンドリア内部でのα-シヌクレイン発現のしかたは脳内の部位によって異なり、この発現の程度が、ミトコンドリア機能に影響し、また神経変性を起こしやすくなる潜在的因子である可能性がある[18]。
SNCA遺伝子の選択的スプライシングによって、少なくとも3種のアイソフォーム (アミノ酸残基の配列は多少異なるが、働きそのものは変わらないタンパク質en) が産生される[9]。よく研究されている主要なものは140アミノ酸残基からなるアイソフォームで、遺伝子すべてが翻訳される。その他エクソン3が欠けたα-シヌクレイン126 (41-54残基がない) や、エクソン5を欠いたα-シヌクレイン112[19] (103-130残基がない) などがある[9]。
機能
[編集]学習に伴うシナプス再構築の際に、α-シヌクレインのシナプス前終末における数が特異的に上方制御 (ある刺激によって遺伝子発現が加速し、タンパク質産生が増加する調節) される[20]。α-シヌクレインはチューブリンと相互作用し[8]、(タウタンパクのように) 微小管結合タンパクとなりうる活性を持つことが示されている[21]。
SNAREタンパク質複合体 (神経伝達物質放出において、シナプス小胞と細胞膜の融合にかかわる物質) の形成に際して、α-シヌクレインが分子シャペロンとして働いている可能性が示唆されている[22][23]。特に、N末端ドメインで細胞膜のリン脂質と、C末端ドメインでシナプトブレビン-2 (SNAREタンパクの一種) と同時に結合するが、これはシナプス活性化の際には特に重要である[24]。α-シヌクレインが神経細胞のゴルジ装置や小胞輸送の機能にかかわっている、という証拠は増えつつある[25]。
脂質膜との相互作用
[編集]α-シヌクレインと膜の相互関係や、膜の合成と再生へのかかわりについても証拠が蓄積されつつある。酵母ゲノムスクリーニングで、脂質代謝にかかわる酵素の中にα-シヌクレインの毒性を増強するものがあることもわかった[26]。逆にα-シヌクレインの発現レベルは、脂質二重層内にある脂肪酸の、粘度と相対的な量に影響している[27]。
α-シヌクレインは脂質膜の負に帯電した表面に直接結合し[27]、単層小胞に結合した状態では伸展したαヘリックス構造をとる[28]。また小さな小胞に結合する傾向があり[29]、脂質膜に結合することによって二重膜構造を変化させ、小さな小胞を形成させるという複雑な効果を及ぼす[30]。すなわち負の電荷をもつ小胞の膜を折り曲げて、大きな小胞から細い環を形成する[31]。膜における抗酸化活性を持つ可能性も指摘されている[32]。

アミノ酸配列
[編集]α-シヌクレインの一次構造は、通常次の3つのドメインから構成される
- 第1-60残基:両親媒性のN末端領域で、共通配列 KTKEGV (リシン-スレオニン-リシン-グルタミン酸-グリシン-バリン) を含む11残基の不完全な7回繰り返しが中心である。この配列はアポリポタンパク質の脂質結合領域に相同で、αヘリックス構造をとりやすい[33]。
- 61-95残基:この中間部は疎水性領域で、非アミロイド成分 (non-amyloid component NAC) と呼ばれるタンパク凝集する部分である[5]。
- 96-140残基:酸性度が高くプロリンを豊富に含む領域で、特定の構造をとらない。ある種のキナーゼによるチロシン125とセリン129のリン酸化が、α-シヌクレインの機能調節に関与している[34][35][36]。
自己タンパク質分解活性
[編集]インビトロでα-シヌクレインをインキュベートする (恒温に保つ) と、自己分解して低分子量の様々な断片を生成することがわかる (高速液体クロマトグラフィー、高分解能イオン移動度質量分析器を用いた検出による)[37]。もとの14.46kDa (キロダルトン) のタンパクから多数の断片が生じることが分かっており、例えばC末端やN末端が切断されてできる12.16kDaの断片 (14-133アミノ酸残基) 、10.44kDaの断片 (40-140アミノ酸残基) およびC末端の断片である7.27kDa (72-140) がある)[37]。7.27kDaの断片はNAC領域の大部分を含んでおり、未分解のα-シヌクレインに比べてずっと速く凝集する。これらの分解産物が生体内 (インビボ) でも、α-シヌクレイン凝集に対して仲介・補助的に働いている可能性がある。
臨床的重要性
[編集]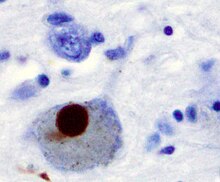
α-シヌクレインは長らく可溶性の天然変性タンパク質であると考えられてきたが、変異のない場合は安定な折りたたまれた4量体を形成し、凝集抵抗性を持つと思われる知見が得られている[38]。にもかかわらず、パーキンソン病・レビー小体型認知症[39]・多系統萎縮症[40]のような疾患では、レビー小体に代表される不溶性の原線維を形成するため、これらの疾患はシヌクレイノパチーと呼ばれる。α-シヌクレインはレビー小体中のフィラメントとして代表的な構造体だが、レビー小体中にタウタンパク質が存在したり[41]、また同一封入体中にα-シヌクレインとタウタンパク質のフィラメントがそれぞれ集合して存在していることもある[42]。病的なα-シヌクレインはまた、孤発性および家族性アルツハイマー病のどちらの場合にもみられる[43]。
α-シヌクレインの凝集メカニズムについては、かなり不明な点が多いが、凝集の前駆体としてまずβ構造に富む中間構造物を形成し、その後レビー小体になるという証拠も存在する[44]。天然変性、αヘリックス、βシートに富む構造のそれぞれが混在し、平衡状態にあることを示唆する1分子レベルの研究もある。凝集を促進することがわかっている条件 -A30P (30番目のアミノ酸がアラニンからプロリンに変化する) 点変異やイオン強度の上昇といった緩衝液の変化- の下では、平衡状態が移動してβ構造の量が著しく増加することから、β構造が病的な凝集に関与していることが考えられる[45]。α-シヌクレイン凝集が関与する疾患に対する治療戦略は様々考えられるが、凝集の阻害物質を使用する方法は重要である。例えばクミンアルデヒドは、低分子ながらα-シヌクレインの原線維化を阻害することが示されている[46]。エプスタイン・バール・ウイルスもこれらの病態に関与している[47]。
家族性パーキンソン病の中に、α-シヌクレインをコードする遺伝子が変異している稀なタイプが存在する。A53T[48] (53番目のアラニンがスレオニンに)、A30P[49] (30番目のアラニンがプロリンに)、E46K[50] (46番目のグルタミン酸がリシンに) の3つの点変異がこれまでに同定されているほか、遺伝子重複 (二重複、三重複) も家族性パーキンソン病の原因となることがわかっている[51] (こちらの方が点変異よりも数は多い)。このように、α-シヌクレインの変異によってアミロイド類似の原線維形成が起こり、パーキンソン病の原因となることがある。
以前までの抗ユビキチン抗体に代わって、抗α-シヌクレイン抗体 (リン酸化α-シヌクレイン特異抗体) がレビー小体免疫染色のゴールドスタンダードとして用いられるようになっている[52]。
α-シヌクレインの断片の中には、タウオパチー (タウタンパク質が原因となる疾患群) に関与しているものがある[53]。

左図は、以上の経路における既知の修飾である。神経内部の電気的活性はα-シヌクレインと小胞との結合状態を変化させ、またPLK2 (polo-like kinase, 細胞周期の調節に関係するセリン-スレオニンキナーゼの一種) を刺激してセリン129をリン酸化する。これ以外のプロテインキナーゼの関与を主張する説もある。リン酸化以外には、カルパインによる切断や、おそらくNO (一酸化窒素) をはじめ炎症反応中に存在する活性窒素種(Reactive nitrogen species)なども凝集性を高めるような修飾を行う。レビー小体のユビキチン化 (小さな黒丸で図示) も、おそらくは沈着の2次的過程である。
右図は、α-シヌクレインによる毒性の細胞内標的の仮説である。上から順に、小胞体-ゴルジ装置輸送 (輸送が阻害され、小胞体ストレスとゴルジ装置の断片化が起きる)、シナプス小胞 (神経伝達物質の放出が減少)、ミトコンドリア(エネルギー産生が傷害され、アポトーシスを誘導する)、およびリソソームとその他のタンパク分解機構 (シャペロン介在性オートファジーの基質蓄積、プロテアソーム傷害)。いずれの場合も、括弧内に示すような有害な影響を及ぼすと考えられている。ただしいずれの場合も、神経毒性に関して必要十分に説明し得るかは、はっきりしていない。
タンパク質間相互作用
[編集]α-シヌクレインは、以下の分子と相互に作用する。
- ドーパミン輸送体[55][56]
- パーキン[57][58]:家族性パーキンソン病の原因となるリガーゼの一種
- ホスホリパーゼD1[59]
- シンフィリン-1 (SNCAIP)[60][61][62][63]
- タウタンパク質[64][65]
- アミロイドベータタンパク質[66]
関連項目
[編集]- コントゥルシ・テルメ - α-シヌクレインの遺伝子変異による家族性パーキンソン病の家系が存在するイタリアの村
- TMAO - 凝集を抑制するオスモライト
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000145335 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000025889 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ a b Uéda K, Fukushima H, Masliah E, Xia Y, Iwai A, Yoshimoto M, Otero DA, Kondo J, Ihara Y, Saitoh T (December 1993). “Molecular cloning of cDNA encoding an unrecognized component of amyloid in Alzheimer disease”. Proc. Natl. Acad. Sci. U.S.A. 90 (23): 11282?6. doi:10.1073/pnas.90.23.11282. PMC 47966. PMID 8248242.
- ^ Xia Y, Saitoh T, Uéda K, Tanaka S, Chen X, Hashimoto M, Hsu L, Conrad C, Sundsmo M, Yoshimoto M, Thal L, Katzman R, Masliah E (October 2001). “Characterization of the human alpha-synuclein gene: Genomic structure, transcription start site, promoter region and polymorphisms”. J. Alzheimers Dis. 3 (5): 485?494. PMID 12214035.
- ^ Xia Y, Saitoh T, Uéda K, Tanaka S, Chen X, Hashimoto M, Hsu L, Conrad C, Sundsmo M, Yoshimoto M, Thal L, Katzman R, Masliah E (2002). “Characterization of the human alpha-synuclein gene: Genomic structure, transcription start site, promoter region and polymorphisms: Erratum p489 Fig 3”. J. Alzheimers Dis. 4 (4): 337.
- ^ a b Alim MA, Hossain MS, Arima K, Takeda K, Izumiyama Y, Nakamura M, Kaji H, Shinoda T, Hisanaga S, Ueda K. (Jan 2002). “Tubulin seeds alpha-synuclein fibril formation.”. J. Biol. Chem. 277 (3): 2112?7. doi:10.1074/jbc.M102981200. PMID 11698390.
- ^ a b c Beyer K (September 2006). “Alpha-synuclein structure, posttranslational modification and alternative splicing as aggregation enhancers”. Acta Neuropathol. 112 (3): 237?51. doi:10.1007/s00401-006-0104-6. PMID 16845533.
- ^ Iwai A, Masliah E, Yoshimoto M, Ge N, Flanagan L, de Silva HA, Kittel A, Saitoh T (February 1995). “The precursor protein of non-A beta component of Alzheimer's disease amyloid is a presynaptic protein of the central nervous system”. Neuron 14 (2): 467?75. doi:10.1016/0896-6273(95)90302-X. PMID 7857654.
- ^ Mori, F; Tanji, K; Yoshimoto, M; Takahashi, H; Wakabayashi, K (Jul 2002). “Demonstration of alpha-synuclein immunoreactivity in neuronal and glial cytoplasm in normal human brain tissue using proteinase K and formic acid pretreatment”. Exp Neurol 176 (1): 98-104. PMID 12093086.
- ^ Hoek KS, Schlegel NC, Eichhoff OM, Widmer DS, Praetorius C, Einarsson SO, Valgeirsdottir S, Bergsteinsdottir K, Schepsky A, Dummer R, Steingrimsson E (2008). “Novel MITF targets identified using a two-step DNA microarray strategy” (full text). Pigment Cell Melanoma Res. 21 (6): 665?76. doi:10.1111/j.1755-148X.2008.00505.x. PMID 19067971.
- ^ Yu S, Li X, Liu G, Han J, Zhang C, Li Y, Xu S, Liu C, Gao Y, Yang H, Uéda K, Chan P (March 2007). “Extensive nuclear localization of alpha-synuclein in normal rat brain neurons revealed by a novel monoclonal antibody”. Neuroscience 145 (2): 539?55. doi:10.1016/j.neuroscience.2006.12.028. PMID 17275196.
- ^ McLean PJ, Kawamata H, Ribich S, Hyman BT (March 2000). “Membrane association and protein conformation of alpha-synuclein in intact neurons. Effect of Parkinson's disease-linked mutations”. J. Biol. Chem. 275 (12): 8812?6. doi:10.1074/jbc.275.12.8812. PMID 10722726.
- ^ Davidson WS, Jonas A, Clayton DF, George JM (Apr 1998). “Stabilization of alpha-synuclein secondary structure upon binding to synthetic membranes” (free full text). J Biol Chem 273 (16): 9443-9449. doi:10.1074/jbc.273.16.9443. PMID 9545270.
- ^ Lee HJ, Choi C, Lee SJ (January 2002). “Membrane-bound alpha-synuclein has a high aggregation propensity and the ability to seed the aggregation of the cytosolic form”. J. Biol. Chem. 277 (1): 671?8. doi:10.1074/jbc.M107045200. PMID 11679584.
- ^ Zhang L, Zhang C, Zhu Y, Cai Q, Chan P, Uéda K, Yu S, Yang H (December 2008). “Semi-quantitative analysis of alpha-synuclein in subcellular pools of rat brain neurons: an immunogold electron microscopic study using a C-terminal specific monoclonal antibody”. Brain Res 1244: 40?52. doi:10.1016/j.brainres.2008.08.067. PMID 18817762.
- ^ a b Liu G, Zhang C, Yin J, Li X, Cheng F, Li Y, Yang H, Uéda K, Chan P, Yu S (May 2009). “Alpha-Synuclein is differentially expressed in mitochondria from different rat brain regions and dose-dependently down-regulates complex I activity”. Neurosci. Lett. 454 (3): 187?92. doi:10.1016/j.neulet.2009.02.056. PMID 19429081.
- ^ Uéda K, Saitoh T, Mori H (December 1994). “Tissue-dependent alternative splicing of mRNA for NACP, the precursor of non-A beta component of Alzheimer's disease amyloid.”. Biochem. Biophys. Res. Commun. 205 (2): 1366?72. doi:10.1006/bbrc.1994.2816. PMID 7802671.
- ^ George JM, Jin H, Woods WS, Clayton DF (August 1995). “Characterization of a novel protein regulated during the critical period for song learning in the zebra finch”. Neuron 15 (2): 361?72. doi:10.1016/0896-6273(95)90040-3. PMID 7646890.
- ^ Alim MA, Ma QL, Takeda K, Aizawa T, Matsubara M, Nakamura M, Asada A, Saito T, Kaji H, Yoshii M, Hisanaga S, Ueda K (August 2004). “Demonstration of a role for alpha-synuclein as a functional microtubule-associated protein”. J. Alzheimers Dis. 6 (4): 435?42; discussion 443?9. PMID 15345814.
- ^ Bonini NM, Giasson BI (November 2005). “Snaring the function of alpha-synuclein”. Cell 123 (3): 359?61. doi:10.1016/j.cell.2005.10.017. PMID 16269324.
- ^ Chandra S, Gallardo G, Fernández-Chacón R, Schlüter OM, Südhof TC (November 2005). “Alpha-synuclein cooperates with CSPalpha in preventing neurodegeneration”. Cell 123 (3): 383?96. doi:10.1016/j.cell.2005.09.028. PMID 16269331.
- ^ Burré J, Sharma M, Tsetsenis T, Buchman V, Etherton MR, Sudhof TC (September 2010). “Alpha-synuclein promotes SNARE-complex assembly in vivo and in vitro” (free full text). Science 329 (5999): 1663?7. doi:10.1126/science.1195227. PMID 20798282.
- ^ A. A. Cooper, A. D. Gitler, A. Cashikar, C. M. Haynes, K. J. Hill, B. Bhullar,K. Liu, K. Xu, K. E. Strathearn, F. Liu, S. Cao, K. A. Caldwell, G. A.Caldwell, G. Marsischky, R. D. Kolodner, J. Labaer, J. C. Rochet, N. M.Bonini, and S. Lindquist. (2006). “Alpha-synuclein blocks ER-golgi traffic and Rab1 rescues neuron loss in Parkinson’s models”. Science 313 (5785): 324?328. doi:10.1126/science.1129462. PMC 1983366. PMID 16794039.
- ^ Willingham S, Outeiro TF, DeVit MJ, Lindquist SL, Muchowski PJ (December 2003). “Yeast genes that enhance the toxicity of a mutant huntingtin fragment or alpha-synuclein”. Science 302 (5651): 1769?72. doi:10.1126/science.1090389. PMID 14657499.
- ^ a b Uversky VN (October 2007). “Neuropathology, biochemistry, and biophysics of alpha-synuclein aggregation”. J. Neurochem. 103 (1): 17?37. doi:10.1111/j.1471-4159.2007.04764.x. PMID 17623039.
- ^ Jao CC, Hegde BG, Chen J, Haworth IS, Langen R (December 2008). “Structure of membrane-bound alpha-synuclein from site-directed spin labeling and computational refinement”. Proc. Natl. Acad. Sci. U.S.A. 105 (50): 19666?71. doi:10.1073/pnas.0807826105. PMC 2605001. PMID 19066219.
- ^ Zhu M, Li J, Fink AL (October 2003). “The association of alpha-synuclein with membranes affects bilayer structure, stability, and fibril formation”. J. Biol. Chem. 278 (41): 40186?97. doi:10.1074/jbc.M305326200. PMID 12885775.
- ^ Madine J, Doig AJ, Middleton DA (May 2006). “A study of the regional effects of alpha-synuclein on the organization and stability of phospholipid bilayers”. Biochemistry 45 (18): 5783?92. doi:10.1021/bi052151q. PMID 16669622.
- ^ Varkey J, Isas JM, Mizuno N, Jensen MB, Bhatia VK, Jao CC, Petrlova J, Voss J, Stamou D, Steven AC, Langen R (August 2010). “Membrane curvature induction and tubulation is a common feature of synucleins and apolipoproteins”. J Biol Chem 285 (42): 32486?93. doi:10.1074/jbc.M110.139576. PMC 2952250. PMID 20693280.
- ^ Zhu M, Qin ZJ, Hu D, Munishkina LA, Fink AL (July 2006). “Alpha-synuclein can function as an antioxidant preventing oxidation of unsaturated lipid in vesicles”. Biochemistry 45 (26): 8135?42. doi:10.1021/bi052584t. PMID 16800638.
- ^ Clayton D.F. and George J.M. (1998). “The synucleins: a family of proteins involved in synaptic function, plasticity, neurodegeneration and disease”. Trends in Neuroscience 21 (6): 249?254. doi:10.1016/S0166-2236(97)01213-7.
- ^ Negro, A; Brunati, AM; Donella-Deana, A; Massimino, ML; Pinna, LA (Feb 2002). “Multiple phosphorylation of alpha-synuclein by protein tyrosine kinase Syk prevents eosin-induced aggregation” (free full text). FASEB J 16 (2): 210-212. doi:10.1096/fj.01-0517fje. PMID 11744621.
- ^ Okochi M, Walter J, Koyama A, Nakajo S, Baba M, Iwatsubo T, Meijer L, Kahle PJ, Haass C (Jan 2000). “Constitutive phosphorylation of the Parkinson's disease associated alpha-synuclein” (free full text). J Biol Chem 275 (1): 390-397. doi:10.1074/jbc.275.1.390. PMID 10617630.
- ^ Ellis CE, Schwartzberg PL, Grider TL, Fink DW, Nussbaum RL (Feb 2001). “α-Synuclein Is Phosphorylated by Members of the Src Family of Protein-tyrosine Kinases” (free full text). J Biol Chem 276 (6): 3879-3884. doi:10.1074/jbc.M010316200. PMID 11078745.
- ^ a b Vlad C, Lindner K, Karreman C, Schildknecht S, Leist M, Tomczyk N, Rontree J, Langridge J, Danzer K, Ciossek T, Petre A, Gross ML, Hengerer B, Przybylski M (December 2011). “Autoproteolytic fragments are intermediates in the oligomerization/aggregation of the Parkinson's disease protein alpha-synuclein as revealed by ion mobility mass spectrometry”. Chembiochem 12 (18): 2740?4. doi:10.1002/cbic.201100569. PMC 3461308. PMID 22162214.
- ^ Bartels T, Choi JG, Selkoe DJ (August 2011). “α-Synuclein occurs physiologically as a helically folded tetramer that resists aggregation”. Nature 477 (7362). doi:10.1038/nature10324. PMID 21841800. 非専門家向けの内容要旨 – Harvard Medical School New Focus.
- ^ Arima K, Uéda K, Sunohara N, Hirai S, Izumiyama Y, Tonozuka-Uehara H, Kawai M (October 1998). “Immunoelectron-microscopic demonstration of NACP/alpha-synuclein-epitopes on the filamentous component of Lewy bodies in Parkinson's disease and in dementia with Lewy bodies”. Brain Res. 808 (1): 93?100. doi:10.1016/S0006-8993(98)00734-3. PMID 9795161.
- ^ Arima K, Uéda K, Sunohara N, Arakawa K, Hirai S, Nakamura M, Tonozuka-Uehara H, Kawai M (November 1998). “NACP/alpha-synuclein immunoreactivity in fibrillary components of neuronal and oligodendroglial cytoplasmic inclusions in the pontine nuclei in multiple system atrophy”. Acta Neuropathol. 96 (5): 439?44. doi:10.1007/s004010050917. PMID 9829806.
- ^ Arima K, Hirai S, Sunohara N, Aoto K, Izumiyama Y, Uéda K, Ikeda K, Kawai M (October 1999). “Cellular co-localization of phosphorylated tau- and NACP/alpha-synuclein-epitopes in Lewy bodies in sporadic Parkinson's disease and in dementia with Lewy bodies”. Brain Res. 843 (1): 53?61. doi:10.1016/S0006-8993(99)01848-X. PMID 10528110.
- ^ Arima K, Mizutani T, Alim MA, Tonozuka-Uehara H, Izumiyama Y, Hirai S, Ueda K (August 2000). “NACP/alpha-synuclein and tau constitute two distinctive subsets of filaments in the same neuronal inclusions in brains from a family of parkinsonism and dementia with Lewy bodies: double-immunolabeling fluorescence and electron microscopic studies”. Acta Neuropathol. 100 (2): 115?21. doi:10.1007/s004010050002. PMID 10963357.
- ^ Yokota O, Terada S, Ishizu H, Ujike H, Ishihara T, Nakashima H, Yasuda M, Kitamura Y, Uéda K, Checler F, Kuroda S (December 2002). “NACP/alpha-synuclein, NAC, and beta-amyloid pathology of familial Alzheimer's disease with the E184D presenilin-1 mutation: a clinicopathological study of two autopsy cases”. Acta Neuropathol. 104 (6): 637?48. doi:10.1007/s00401-002-0596-7. PMID 12410385.
- ^ Kim HY, Heise H, Fernandez CO, Baldus M, Zweckstetter M (September 2007). “Correlation of amyloid fibril beta-structure with the unfolded state of alpha-synuclein”. Chembiochem 8 (14): 1671?4. doi:10.1002/cbic.200700366. PMID 17722123.
- ^ Sandal M, Valle F, Tessari I, Mammi S, Bergantino E, Musiani F, Brucale M, Bubacco L, Samori B (January 2008). “Conformational equilibria in monomeric α-synuclein at the single-molecule level”. PLoS Biol. 6 (1): e6. doi:10.1371/journal.pbio.0060006. PMC 2174973. PMID 18198943.
- ^ Morshedi D, Aliakbari F, (Spring 2012). “The Inhibitory Effects of Cuminaldehyde on Amyloid Fibrillation and Cytotoxicity of Alpha-synuclein”. modares journal of medical sciences: pathobiology 15 (1): 45-60.
- ^ Woulfe J, Hoogendoorn H, Tarnopolsky M, Muñoz DG. (Nov14). “Monoclonal antibodies against Epstein-Barr virus cross-react with alpha-synuclein in human brain.”. Neurology 55 (9): 1398-1401. PMID 11087792.
- ^ “Mutation in the alpha-synuclein gene identified in families with Parkinson's disease”. Science 276 (5321): 2045?7. (1997). doi:10.1126/science.276.5321.2045. PMID 9197268.
- ^ Li J, Uversky VN, Fink AL (September 2001). “Effect of familial Parkinson's disease point mutations A30P and A53T on the structural properties, aggregation, and fibrillation of human alpha-synuclein”. Biochemistry 40 (38): 11604?13. doi:10.1021/bi010616g. PMID 11560511.
- ^ Zarranz JJ, Alegre J, Gómez-Esteban JC, Lezcano E, Ros R, Ampuero I, Vidal L, Hoenicka J, Rodriguez O, Atarés B, Llorens V, Gomez Tortosa E, del Ser T, Muñoz DG, de Yebenes JG (February 2004). “The new mutation, E46K, of alpha-synuclein causes Parkinson and Lewy body dementia”. Ann. Neurol. 55 (2): 164?73. doi:10.1002/ana.10795. PMID 14755719.
- ^ Singleton AB, Farrer M, Johnson J, Singleton A, Hague S, Kachergus J, Hulihan M, Peuralinna T, Dutra A, Nussbaum R, Lincoln S, Crawley A, Hanson M, Maraganore D, Adler C, Cookson MR, Muenter M, Baptista M, Miller D, Blancato J, Hardy J, Gwinn-Hardy K (October 2003). “alpha-Synuclein locus triplication causes Parkinson's disease”. Science 302 (5646): 841. doi:10.1126/science.1090278. PMID 14593171.
- ^ Fujiwara H, Hasegawa M, Dohmae N, Kawashima A, Masliah E, Goldberg MS, Shen J, Takio K, Iwatsubo T (Feb 2002). “alpha-Synuclein is phosphorylated in synucleinopathy lesions”. Nat Cell Biol 4 (2): 160-164. PMID 11813001.
- ^ Takeda A, Hashimoto M, Mallory M, Sundsumo M, Hansen L, Masliah E (March 2000). “C-terminal alpha-synuclein immunoreactivity in structures other than Lewy bodies in neurodegenerative disorders”. Acta Neuropathol. 99 (3): 296?304. doi:10.1007/PL00007441. PMID 10663973.
- ^ Cookson MR (2009). “alpha-Synuclein and neuronal cell death”. Mol Neurodegener 4: 9. doi:10.1186/1750-1326-4-9. PMC 2646729. PMID 19193223.
- ^ Wersinger C, Sidhu A (April 2003). “Attenuation of dopamine transporter activity by alpha-synuclein”. Neurosci. Lett. 340 (3): 189?92. doi:10.1016/S0304-3940(03)00097-1. PMID 12672538.
- ^ Lee FJ, Liu F, Pristupa ZB, Niznik HB (April 2001). “Direct binding and functional coupling of alpha-synuclein to the dopamine transporters accelerate dopamine-induced apoptosis”. FASEB J. 15 (6): 916?26. doi:10.1096/fj.00-0334com. PMID 11292651.
- ^ Choi P, Golts N, Snyder H, Chong M, Petrucelli L, Hardy J, Sparkman D, Cochran E, Lee JM, Wolozin B (September 2001). “Co-association of parkin and alpha-synuclein”. NeuroReport 12 (13): 2839?43. PMID 11588587.
- ^ Kawahara K, Hashimoto M, Bar-On P, Ho GJ, Crews L, Mizuno H, Rockenstein E, Imam SZ, Masliah E (March 2008). “alpha-Synuclein aggregates interfere with Parkin solubility and distribution: role in the pathogenesis of Parkinson disease”. J. Biol. Chem. 283 (11): 6979?87. doi:10.1074/jbc.M710418200. PMID 18195004.
- ^ Ahn BH, Rhim H, Kim SY, Sung YM, Lee MY, Choi JY, Wolozin B, Chang JS, Lee YH, Kwon TK, Chung KC, Yoon SH, Hahn SJ, Kim MS, Jo YH, Min DS (April 2002). “alpha-Synuclein interacts with phospholipase D isozymes and inhibits pervanadate-induced phospholipase D activation in human embryonic kidney-293 cells”. J. Biol. Chem. 277 (14): 12334?42. doi:10.1074/jbc.M110414200. PMID 11821392.
- ^ Neystat M, Rzhetskaya M, Kholodilov N, Burke RE (June 2002). “Analysis of synphilin-1 and synuclein interactions by yeast two-hybrid beta-galactosidase liquid assay”. Neurosci. Lett. 325 (2): 119?23. doi:10.1016/S0304-3940(02)00253-7. PMID 12044636.
- ^ Reed JC, Meister L, Tanaka S, Cuddy M, Yum S, Geyer C, Pleasure D (December 1991). “Differential expression of bcl2 protooncogene in neuroblastoma and other human tumor cell lines of neural origin”. Cancer Res. 51 (24): 6529?38. PMID 1742726.
- ^ Kawamata H, McLean PJ, Sharma N, Hyman BT (May 2001). “Interaction of alpha-synuclein and synphilin-1: effect of Parkinson's disease-associated mutations”. J. Neurochem. 77 (3): 929?34. doi:10.1046/j.1471-4159.2001.00301.x. PMID 11331421.
- ^ Engelender S, Kaminsky Z, Guo X, Sharp AH, Amaravi RK, Kleiderlein JJ, Margolis RL, Troncoso JC, Lanahan AA, Worley PF, Dawson VL, Dawson TM, Ross CA (May 1999). “Synphilin-1 associates with alpha-synuclein and promotes the formation of cytosolic inclusions”. Nat. Genet. 22 (1): 110?4. doi:10.1038/8820. PMID 10319874.
- ^ Jensen PH, Hager H, Nielsen MS, Hojrup P, Gliemann J, Jakes R (September 1999). “alpha-synuclein binds to Tau and stimulates the protein kinase A-catalyzed tau phosphorylation of serine residues 262 and 356”. J. Biol. Chem. 274 (36): 25481?9. doi:10.1074/jbc.274.36.25481. PMID 10464279.
- ^ Giasson BI, Lee VM, Trojanowski JQ (2003). “Interactions of amyloidogenic proteins”. Neuromolecular Med. 4 (1-2): 49?58. doi:10.1385/NMM:4:1-2:49. PMID 14528052.
- ^ Ono, Kenjiro; Takahashi, Ryoichi; Ikedia, Tokuhei; Yamada, Masahito (2012). “Cross-seeding effects of amyloid β-protein and α-synuclein”. Journal of Neurochemistry 122 (5): 883-90. doi:10.1111/j.1471-4159.2012.07847.x. PMID 22734715 13 February 2013閲覧。.
外部リンク
[編集] ウィキメディア・コモンズには、α-シヌクレインに関するメディアがあります。
ウィキメディア・コモンズには、α-シヌクレインに関するメディアがあります。- alpha-Synuclein - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス