سدیم هیدروکسید
| سدیم هیدروکسید | |
|---|---|
| |

| |
Sodium hydroxide[نیازمند منبع] | |
Sodium oxidanide[نیازمند منبع] | |
دیگر نامها Caustic soda[نیازمند منبع] | |
| شناساگرها | |
| شماره ثبت سیایاس | ۱۳۱۰-۷۳-۲ |
| پابکم | ۱۴۷۹۸ |
| کماسپایدر | ۱۴۱۱۴ |
| UNII | 55X04QC32I |
| شمارهٔ ئیسی | 215-185-5 |
| شمارهٔ یواِن | 1823 |
| KEGG | D01169 |
| MeSH | Sodium+Hydroxide |
| ChEBI | CHEBI:32145 |
| شمارهٔ آرتیئیسیاس | WB4900000 |
| 68430 | |
| جیمول-تصاویر سه بعدی | Image 1 |
| |
| |
| خصوصیات | |
| فرمول مولکولی | NaOH |
| جرم مولی | 39.9971 g mol-1 |
| شکل ظاهری | White waxy opaque crystals |
| چگالی | 2.13 g cm-3 |
| دمای ذوب | ۳۱۸ درجه سلسیوس (۶۰۴ درجه فارنهایت؛ ۵۹۱ کلوین) |
| دمای جوش | ۱٬۳۸۸ درجه سلسیوس (۲٬۵۳۰ درجه فارنهایت؛ ۱٬۶۶۱ کلوین) |
| انحلالپذیری در آب | 1110 g dm-3 (at 20 °C) |
| انحلالپذیری در methanol | 238 g dm-3 |
| انحلالپذیری در ethanol | <<139 g dm-3 |
| فشار بخار | <2.4 kPa (at 20 °C) |
| اسیدی (pKa) | 13 |
| ضریب شکست (nD) | 1.412 |
| ترموشیمی | |
آنتروپی مولار
استاندارد S |
64.46 J K-1 mol-1 |
آنتالپی استاندارد
تشکیل ΔfH |
-425.93 kJ mol-1 |
| خطرات | |
| MSDS | External MSDS |
| GHS pictograms | 
|
| شاخص ئییو | ۰۱۱-۰۰۲-۰۰-۶ |
| طبقهبندی ئییو | |
| کدهای ایمنی | R۳۵ |
| شمارههای نگهداری | (S1/2), S26, S37/39, S45 |
| لوزی آتش | |
| ترکیبات مرتبط | |
| دیگر آنیونها | سدیم هیدروسولفید |
| دیگر کاتیونها | سزیم هیدروکسید Lithium hydroxide پتاسیم هیدروکسید روبیدیم هیدروکسید |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| | |
| Infobox references | |
|
| |
سدیم هیدروکسید (به انگلیسی: Sodium hydroxide) یا سود سوزآور (به انگلیسی: Caustic Soda) ترکیبی معدنی با فرمول شیمیایی NaOH است. این ماده یک ترکیب یونی جامد سفیدرنگ است که از کاتیون سدیم (+Na) و آنیون هیدروکسید (-OH) تشکیل شدهاست. این ترکیب، در تماس با پوست میتواند سوختگی شیمیایی شدید ایجاد کند.[۱][۲] سدیم هیدروکسید به شدت در آب انحلالپذیر بوده و به راحتی رطوبت و کربن دیاکسید موجود در هوا را جذب میکند.[۳]
سدیم هیدروکسید جامد بیشتر به صورت پرک (فلکس)، دانهای و بلوکهای قالبی برای فروش عرضه میشود.[۴]
پرک این ماده در ایران با نام چنته به عنوان بازکنندهٔ لولههای فاضلاب به فروش میرسد.[نیازمند منبع]
تاریخچه
[ویرایش]سدیم هیدروکسید در ابتدا توسط سازندگان صابون تولید میشد.[۵] دستورالعملی از ساخت سدیم هیدروکسید توسط دانشمند مسلمان قرن ۱۳ میلادی "المختاره" در کتاب " المخترع فی فنون من الصنع " یافت شدهاست که توسط "المظفر یوسف ابن عمر ابن علی ابن رسول" پادشاه یمن گردآوری شدهاست. شیمیدان و باستانشناس انگلیسی "هنری ارنست استپالتون (۱۸۷۸–۱۹۶۲)" شواهدی ارائه دادهاست که محمد زکریای رازی سدیم هیدروکسید را میشناختهاست.[۶] این دستورالعمل شامل گذراندن پیدرپی آب از درون مخلوطی از قلیا که خاکستر علف شور (Saltwort) بود و آهک خام بود که به این روش سدیم هیدروکسید بهدست میآمد. صابونسازان اروپایی همین دستورالعمل را پیروی میکردند.[۷]
روشهای تهیه
[ویرایش]الکترولیز محلول سدیم کلرید
[ویرایش]بیشترین مقدار هیدروکسید سدیم تولیدی، از طریق فرایند الکترولیز محلولهای سدیم کلرید در یکی از انواع ظروف الکترولیتی بهدست میآید. به عنوان نمونه، در فرایند پیل جیوه (کاستنر-کلنر Castner-Kellner)، از جریانی از جیوه به عنوان کاتد استفاده میشود و ملغمهٔ سدیم حاصل با آب ترکیب میشود و تولید سدیم هیدروکسید مینماید و در فرایند دیگر به نام پیل دیافراگم، الکترولیت از آند به کاتد حرکت میکند و دیافراگم (از جنس پنبهٔ کوهی یا سایر مواد غشایی)، فراوردههای آند و کاتد را از هم جدا میسازد. در هر دو فرایند، علاوه بر سدیم هیدروکسید، گاز کلر و نیز گاز هیدروژن تولید میشود.
فرایند سودا-آهک
[ویرایش]یک فرایند قدیمیتر برای تولید سود سوزآور، عبارت از فرایند سودا - آهک است که در آن سودا اَش (کلسیم هیدروکسید)، در واکنش با سدیم کربنات به کاستیک سودا تبدیل میشود.
- Ca(OH)۲ + Na۲CO۳ → CaCO۳ + ۲ NaOH
کاربردها
[ویرایش]سدیم هیدروکسید، به عنوان یک باز قوی، یکی از مواد شیمیایی صنعتی بسیار مهم بهشمار میرود. برای نمونه، تولید سود در سال ۱۹۸۰ در آمریکا، ۱۲ میلیون تن بودهاست. تولید این مادهٔ شیمیایی پایه؛ که در تولید تمامی انواع مواد شیمیایی به نحوی کاربرد دارد، از ۶۰۳۹۰ کیلوتن در سال ۲۰۱۲ به ۷۲۱۰۳ کیلوتن در سال ۲۰۱۶ افزایش یافت که میانگین رشد ۴٫۵۳ درصد است.
چین بزرگترین تولیدکنندهٔ سود جهان است که ۴۵٫۵۵ درصد از سهم بازار در صنعت سدیم هیدروکسید را در سال ۲۰۱۶ داشت. در بازار مصرف، چین و آمریکای شمالی، اصلیترین مصرفکنندههای این ماده هستند که برآورد شده به ترتیب ۴۲٫۷۹٪ و ۲۰٫۲۹٪ در سال ۲۰۱۶ مصرف کردهاند.[۸] زمینههای مختلف کاربرد سدیم هیدروکسید از جمله در تولید مواد شیمیایی، ابریشم مصنوعی، خمیر کاغذ و کاغذ، در تولید رنگ، آلومینیم، مواد پتروشیمی و پارچه، صابون و مواد شوینده است.
همچنین در آزمایشگاهها برای تعیین غلظت اسیدهای مجهول در تیتراسیون اسید- باز از محلول قلیایی سدیم هیدروکسید استاندارد استفاده میشود. در صنایع غذایی از این ماده جهت تلخیزدایی از زیتون استفاده میشود. سود سوزآور در دو نوع مایع و جامد در کارخانهها تولید میشود.
کاربردهای سود کاستیک پرک (به انگلیسی: Caustic Soda Flakes) در صنعت بسیار وسیع است، صنایع مختلف با رویکردهای مختلف از این ماده استفاده میکنند. برخی از این صنایع عبارتاند از:
- صنایع رنگرزی
- تولید کارتن و کاغذ
- صنایع چرم و نساجی
- صنایع نفت و گاز و پتروشیمی
- خنثیسازی اسید و باتریسازی
- چربیگیرها و سایر صنایع وابسته
- صنایع غذایی، صنایع شیر، کنسروسازی
- نوشابهسازی، کارخانهٔ قند و شکر، کارخانهٔ روغن
- صنایع داروسازی، الکلسازی و آرایشی و بهداشتی
- صنایع فلزی و تولید شیشه، روی، آلومینیم، گالوانیزه و آبکاری
- سود پرک کاربرد فراوانی در صنعت نفت و گاز دارد
- سود پرک کاربرد فراوانی در صنایع نظامی دارد.
- سود پرک برای صنایعی که با عوامل بیماریزا مواجه میشوند هم کاربرد دارد.
- سود پرک در صنعت پلیمر و پت هم مصرف فراوانی دارد و بهعنوان چربیبر استفاده میشود.
آزمایشها
[ویرایش]اگر سدیم هیدروکسید با هیدروکلریک اسید مخلوط شود مادهای به نام سدیم کلرید بهوجود میآید. علاوه بر این واکنش، واکنشی نیز بین سدیم هیدروکسید و نیتریک اسید نیز وجود دارد که طی این واکنش، سدیم نیترات بهوجود میآید. نحوهٔ ساخت سدیم هیدروکسید نیز روش جالب و بسیار سادهای است: سدیم را درون آب میریزیم در صورتی که مقدار سدیم زیاد باشد خطر آتشسوزی و انفجار نیز وجود دارد.
واکنش با فلزات
[ویرایش]سدیم هیدروکسید (NaOH) یک قلیایی قوی است و میتواند با برخی فلزات واکنش دهد. در زیر به چند گروه از فلزات که با سدیم هیدروکسید واکنش میدهند اشاره شده است:
1- فلزات قلیایی
[ویرایش]لیتیوم (Li)، سدیم (Na) و پتاسیم (K): این فلزات با سدیم هیدروکسید واکنش نمیدهند چون خودشان از فلزات قلیایی هستند و در شرایط خاص میتوانند قلیایی شوند.
2- فلزات قلیایی خاکی
[ویرایش]کلسیم (Ca)، باریم (Ba) و منیزیم (Mg): این فلزات با سدیم هیدروکسید واکنش داده و هیدروکسیدهای مربوطه را تشکیل میدهند.
3- فلزات انتقالی
[ویرایش]آلومینیوم (Al): سدیم هیدروکسید در واکنش با فلز آلومینیم گاز هیدروژن تولید میکند. واکنش به صورت زیر است:
- 2Al + 2 NaOH + 6 H2O → 2 NaAl(OH)4 + 3 H2
روی (Zn): همچنین با سدیم هیدروکسید واکنش میدهد و هیدروژن تولید میکند:
Zn + 2NaOH + 2H2O → Na 2 [Zn(OH)4]+H2
4- فلزات دیگر
[ویرایش]آهن (Fe): در صورت وجود رطوبت و در دماهای بالا میتواند با سدیم هیدروکسید واکنش دهد و هیدروکسید آهن تولید کند.
ایمنی
[ویرایش]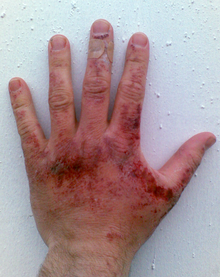
مانند دیگر اسیدهای خوراکی و قلیایی، تنها قطرهای از محلول سدیم هیدروکسید میتواند بهراحتی پروتئینها و چربیها را در بافتهای زنده از طریق هیدرولیز آمید و هیدرولیز استر تجزیه کند، که در نتیجه باعث سوختگیهای شیمیایی میشود و ممکن است باعث ایجاد کوری دائمی در هنگام تماس با چشم شود. قلیای جامد آن همچنین میتواند در صورت وجود آب، مانند بخار آب، طبیعت خورندهٔ خود را نشان دهد؛ بنابراین، هنگام استفاده از این مواد شیمیایی یا محلولهای آن، همیشه باید از تجهیزات حفاظتی مانند دستکشهای لاستیکی، لباس ایمنی و حفاظت چشم استفاده شود. اقدامات استاندارد اولیه برای شستشوی مادهٔ قلیایی از روی پوست، مانند سایر مواد خورندهٔ دیگر، شستوشو با مقدار زیادی آب است. شستشو برای حداقل ۱۰ تا ۱۵ دقیقه باید ادامه یابد.
سلولهای باتری لیتیومی، در صورت بلعیده شدن، حتی اگر خرد نشده باشد باعث آسیب جدی میشود. آسیب، ناشی از محتویات باتری نیست، بلکه جریان الکتریکی ایجاد شده باعث ایجاد سدیم هیدروکسید میشود و مری و رگهای خونی را میسوزاند و میتواند منجر به خونریزی منجر به مرگ شود.
علاوه بر این، انحلال سدیم هیدروکسید بسیار گرمازاست و گرمای حاصل میتواند باعث سوختگی با گرما یا آتش گرفتن مواد آتشگیر شود. همچنین در هنگام واکنش با اسید، گرما تولید میکند.
سدیم هیدروکسید نسبت به شیشه نیز کمی خورنده است، که میتواند باعث آسیب به شفافیت آن شود یا باعث قفل شدن اتصالات شیشهای در همدیگر شود. سدیم هیدروکسید نسبت به فلزات متعددی نیز خورنده است مانند آلومینیم که با تماس با قلیا واکنش نشان میدهد و باعث تولید گاز هیدروژن قابل اشتعال در سطح تماس میشود.
- 2AL+ 6NaOH → 3 H2 + 2 Na3AlO3
- 2Al + 2NaOH + 2H2O → 3 H2 + 2 NaAlO2
- 2Al + 2NaOH + 6H2O → 3 H2 + 2 NaAl(OH)4
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ "Material Safety Datasheet" (PDF). certified-lye.com. Archived from the original (PDF) on 28 February 2008. Retrieved 28 November 2011.
- ↑ "Material Safety Datasheet 2" (PDF). hillbrothers.com. Archived from the original (PDF) on 2012-08-03. Retrieved 2012-05-20.
- ↑ "Examples of Common Laboratory Chemicals and their Hazard Class". Archived from the original on 10 January 2018. Retrieved 9 July 2020.
- ↑ PubChem. "Sodium Hydroxide". pubchem.ncbi.nlm.nih.gov (به انگلیسی). Retrieved 2023-10-09.
- ↑ Sir Thomas Edward Thorpe. A Dictionary Of Applied Chemistry, Volume 5. Nabu Press (April 12, 2012).
- ↑ Memoirs of the Royal Asiatic Society of Bengal, 8 (6). صص. ۳۱۷–۴۱۸.
- ↑ "Sodium hydroxide". Wikipedia (به انگلیسی). 2019-04-30.
- ↑ «نسخه آرشیو شده». بایگانیشده از اصلی در ۲۶ فوریه ۲۰۱۹. دریافتشده در ۲۵ فوریه ۲۰۱۹.


