کاتد

کاتُد (به انگلیسی: cathode) الکترودی منفی که جریان الکتریکی از طریق آن از دستگاه الکتریکی قطبیده خارج میشود. بعبارتی جز پذیرنده الکترون را گویند.
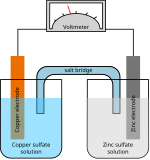
به صورت عامیانه در یک باتری الکترود منفی را آند و الکترود مثبت را کاتد مینامند؛ اما در واقع کاتد الکترودی است که در یک مجموعه دو الکترودی (داخل محلول الکترولیت)، الکترون میگیرد یا جریان الکتریکی (جریان الکتریکی به صورت قراردادی مخالف جهت حرکت الکترون میباشد) از آن خارج میشود. در نتیجه در یک باتری که در حال دشارژ شدن است (در حال مصرف شدن) قطب مثبت کاتد و در یک باتری که در حال شارژ شدن است قطب منفی کاتد نامیده میشود.[۱]
واکنشهای کاتدی
[ویرایش]در طبیعت دو گونه واکنش کاتدی رخ میدهد:
- آزاد شدن هیدروژن که خود دوگونه دارد:
- 2 H+ + 2 e → H
2
- 2 H+ + 2 e → H
- H
2O + 2 e → 2 OH− + H
2
- H
کاهش اکسیژن محلول:
این واکنش در همه محیطها (اسیدی، خنثی، بازی) بدین گونه است:
- O
2 + 4 H+ + 4 e → 2 H
2O
- O
- O
2 + 2 H
2O + 4 e → 4 OH−
- O
واکنش دوم در طبیعت رایجتر است.
قطبیت کاتد به نسبت آند میتواند مثبت یا منفی باشد. این بستگی دارد به اینکه چگونه به وسیله متصل میشود. اگر چه بار مثبت کاتیون همیشه به طرف کاتد حرکت میکند (از جهت نامشان) و بار منفی آنیون بر خلاف آن حرکت میکند. قطبیت کاتد به نوع وسیله بستگی دارد. در وسیلههایی که انرژی مصرف میکنند، کاتد منفی است و در وسائلی که تولید انرژی میکنند کاتد مثبت است. در یک سلول گالوانی کاتد قطب مثبت است چون جریان الکتریکی تولید میشود. این خروج جریان متقابلاً به وسیلهٔ یونهای مثبت انجام میشود. حرکت از الکترولیت به کاتد مثبت (انرژی شیمیایی مسئول انجام این حرکت است) به وسیلهٔ حرکت الکترونهای درونی ادامه مییابد. این بار منفی درون ساختمان مثبت مدار حرکت میکند. برای مثال در سلول گالوانی دانیل مس قطب مثبت و کاتد است و در یک سلول الکترولیتی کاتد قطب منفی میباشد. و در یک دیود کاتد قطب منفی است که جریان را به سمت خارج از وسیله هدایت میکند. در لوله خلاء (شامل لوله پرتو کاتدی) این قطب منفی است که الکترونها را وارد میکند.
جهت حرکت الکترونها:
جهت حرکت الکترونها تقریباً همیشه از آند به کاتد است. صرف نظر از نوع سلول و شیوه عملیاتی آن.
در شیمی: در شیمی کاتد الکترود یک سلول شیمیایی است که در آن کاهش اتفاق میافتد. یک روش حفظی مفید برای یادآوری اکسایش و کاهش این است: استفاده از نمادهای ox و Rec (اکسایش در آند و کاهش در کاتد). روش حفظی دیگر این است که در نوشتن کاتد c وجود دارد مانند reduction بنابراین کاهش در کاتد اتفاق میافتد. کاتد میتواند منفی باشد مانند زمانی که سلول الکترولیتی است (که انرژی الکتریکی برای تجزیه ترکیبات شیمیایی استفاده میشود) یا مثبت باشد مانند زمانی که سلول گالوانی است (که کاهش شیمیایی برای تولید جریان الکتریکی) استفاده میشود.
جستارهای وابسته
[ویرایش]منابع
[ویرایش]Mars G. Fontana, Corrosion Engineering, McGraw-Hill, 1987.