셀룰로스
| |

| |
| 식별자 | |
|---|---|
| ChEMBL | |
| ChemSpider |
|
| ECHA InfoCard | 100.029.692 |
| EC 번호 |
|
| E 번호 | E460 (시그너, ...) |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| 성질 | |
| (C 6H 10O 5) n | |
| 몰 질량 | 162.1406 g/mol per glucose unit |
| 겉보기 | white powder |
| 밀도 | 1.5 g/cm3 |
| 녹는점 | 260–270 °C; 500–518 °F; 533–543 K Decomposes[2] |
| none | |
| 열화학 | |
표준 생성 엔탈피 (ΔfH⦵298)
|
−963,000 J/mol |
표준 연소 엔탈피 (ΔcH⦵298)
|
−2828,000 J/mol |
| 위험 | |
| NFPA 704 (파이어 다이아몬드) | |
| NIOSH (미국 건강 노출 한계): | |
PEL (허용)
|
TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp)[2] |
REL (권장)
|
TWA 10 mg/m3 (total) TWA 5 mg/m3 (resp)[2] |
IDLH (직접적 위험)
|
N.D.[2] |
| 관련 화합물 | |
관련 화합물
|
Starch |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
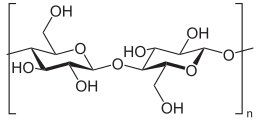
셀룰로스(영어: cellulose), 또는 셀룰로오스는 수백에서 수천 개의 D-포도당 단위체들이 β(1→4) 글리코사이드 결합으로 연결된 선형 사슬이 중첩된 격자형의 다당류로, 화학식이 (C6H10O5)n 인 유기 화합물이다.[3][4] 셀룰로스는 녹색식물, 다양한 형태의 조류 및 난균류의 1차 세포벽의 중요한 구조적인 구성 요소이다. 어떤 종류의 세균은 셀룰로스를 분비하여 미생물막을 형성한다.[5] 셀룰로스는 지구 상에서 가장 풍부한 유기 화합물이다.[6] 식물은 해마다 1014 kg의 셀룰로스를 만들어내는데, 이는 지구상의 유기화합물들 중 가장 많은 양이다.[7] 면섬유의 셀룰로스 함량은 90%이고, 목재의 셀룰로스 함량은 40~50%이며, 건조된 삼(hemp)의 셀룰로스 함량은 약 57%이다.[8][9][10]
셀룰로스는 주로 판지 및 종이 제조에 사용된다. 소량이라도 셀로판, 레이온과 같은 다양한 파생 상품으로 전환된다. 에너지 작물의 셀룰로스를 셀룰로식 에탄올(cellulosic ethanol)과 같은 바이오 연료로 전환하는 것은 재생 가능한 연료 공급원으로 개발 중에 있다. 산업용 셀룰로스는 주로 목재 펄프 및 면섬유로부터 얻는다.[6]
일부 동물들 특히 반추동물과 흰개미는 여정편모충속(Trichonympha) 세균과 같은 장에서 공생하는 미생물의 도움으로 셀룰로스를 소화할 수 있다. 사람의 경우 셀룰로스는 불용성 식이 섬유의 소화가 되지 않는 성분으로 대변을 위한 친수성 팽창제 역할을 하며, 잠재적으로 배변 작용을 돕는다. 소화시 장의 내벽을 기계적으로 자극하여 윤활제를 분비하게 만들어 통과를 돕는다. 이렇게 작용하는 셀룰로스는 섬유소라고 부른다.[11]
역사
[편집]셀룰로스는 1838년 프랑스의 화학자 앙셀름 파얜에 의해서 발견되었는데, 그는 식물 물질로부터 셀룰로스를 분리하고, 셀룰로스의 화학식을 결정했다.[3][12][13] 셀룰로스는 1870년에 하야트 제조회사(Hyatt Manufacturing Company)에 의해 최초의 성공적인 열가소성 플라스틱인 셀룰로이드를 생산하는데 사용되었다. 셀룰로스로부터 레이온(인조 견사)의 생산은 1890년대에 시작되었고, 셀로판은 1912년에 발명되었다. 헤르만 슈타우딩거는 1920년에 셀룰로스의 중합체 구조를 결정했다. 셀룰로스는 1992년에 시로 고바야시(Shiro Kobayashi)와 신이치로 쇼다(Shin‐ichiro Shoda)에 의해 화학적으로 합성(생물학적 효소를 사용하지 않고)되었다.[14]

구조와 특성
[편집]셀룰로스는 무미, 무취이며, 20~30도의 접촉각을 가진 친수성이며,[15] 물과 대부분의 유기 용매에 불용성이며 카이랄성이고 생분해성이다. 셀룰로스는 2016년에 467 °C에서 녹는 것으로 밝혀졌다.[16] 셀룰로스는 고온에서 농축된 무기산으로 처리함으로써 포도당 단위체로서 화학적으로 분해될 수 있다.[17]
셀룰로스는 β-D-포도당들의 1번 탄소(C-1)와 4번 탄소(C-4)가 β(1→4) 글리코사이드 결합을 통해 결합된 선형 구조를 이루며 포도당 단위체가 번갈아가며 뒤집힌 모습을 띤다. 이러한 결합 모티프는 녹말과 글리코젠에 존재하는 α(1→4) 글리코사이드 결합과 대조된다. 이러한 구조로 인해 평행한 셀룰로스 분자들이 근접한 3번 탄소(C-3)와 6번 탄소(C-6)의 하이드록시기 사이에 수소 결합이 형성되어 선형 사슬로 존재하게 된다. 이러한 셀룰로스 분자의 선형 사슬이 약 80개가 모여 생물체 내 기능적 단위체인 셀룰로스 미세섬유(microfibril)를 형성한다.[7] 셀룰로스는 곧은 사슬 중합체이다. 녹말과는 달리 꼬임이나 분지가 일어니지 않으며, 분자는 포도당 잔기의 적도면의 입체구조에 의해 연장된 다소 뻣뻣한 막대 모양의 입체 구조를 채택한다. 셀룰로스 사슬에서 포도당에 있는 여러 개의 하이드록시기는 같은 사슬 내 또는 이웃 사슬에 있는 산소 원자와 수소 결합을 형성하여, 사슬들을 나란히 고정시켜 높은 인장 강도를 갖는 미세섬유를 형성하도록 한다. 이것은 셀룰로스 미세섬유가 다당류 매트릭스에 맞물리는 세포벽에 인장 강도를 부여한다. 셀룰로스 미세섬유의 길이나 너비는 식물의 종류에 따라 달라지는데, 육상식물의 경우 2~5nm 정도의 너비를 보이는데 비해 조류의 경우 폭이 20nm 에 이르며 육상식물에서보다 훨씬 더 질서정연한 구조를 갖는다.[18]


녹말과 비교하여 셀룰로스는 훨씬 더 결정성이다. 녹말은 물에서 60~70 °C 이상으로 가열될 때(요리와 같이) 결정질에서 비결정질로 바뀌는 반면에 셀룰로스는 물에서 비결정질로 되기 위해 320 °C의 온도와 25 MPa의 압력이 필요하다.[19]
셀룰로스의 몇 가지의 다른 결정질 구조가 대표적으로 알려져 있으며, 이는 셀룰로스 가닥 사이와 가닥 내의 수소 결합의 위치에 따라 달라진다. 천연의 셀룰로스는 Iα 구조와 Iβ 구조를 갖는 셀룰로스 I이다. 세균과 조류가 생성하는 셀룰로스는 Iα 가 풍부하고, 고등 식물의 셀룰로스는 주로 Iβ 로 구성된다. 재생 셀룰로스 섬유의 셀룰로스는 셀룰로스 II이다. 셀룰로스 I의 셀룰로스 II 로의 전환은 비가역적이며, 이는 셀룰로스 I 이 준안정적이며, 셀룰로스 II 가 안정하다는 것을 나타낸다. 다양한 화학적 처리로 셀룰로스 III 및 셀룰로스 IV 구조를 생성할 수 있다.[20]
셀룰로스의 많은 특성들은 셀룰로스 사슬의 길이나 중합도, 하나의 중합체 분자를 구성하는 포도당 단위체의 수에 의존한다. 목재 펄프의 셀룰로스는 300~1,700개의 포도당 단위체로 구성된 사슬 길이를 갖는다. 면화, 기타 식물 섬유, 세균의 셀룰로스는 800~10,000개의 포도당 단위체로 구성된 사슬 길이를 갖는다.[6] 셀룰로스의 분해로 인해 매우 짧은 사슬 길이를 갖는 분자는 셀로덱스트린으로 알려져 있다. 긴 사슬의 셀룰로스와는 달리, 셀로덱스트린은 일반적으로 물과 유기 용매에 용해된다.
셀룰로스는 44.44%의 탄소, 6.17%의 수소, 49.39%의 산소를 함유한다. 셀룰로스의 화학식은 (C6H10O5)n 이고, 여기서 n은 중합도이며, 포도당 잔기의 수를 나타낸다.[21]
식물로부터 유래된 셀룰로스는 일반적으로 헤미셀룰로스, 리그닌, 펙틴 및 다른 물질들과의 혼합물로 발견되며, 세균의 셀룰로스는 상당히 순수하고, 더 높은 수분 함량을 갖고 있고, 보다 긴 사슬 길이로 인해 인장 강도가 더 크다.[6]
셀룰로스는 슈바이처 시약, 큐프리에틸렌다이아민(cupriethylenediamine, CED), 카드뮴에틸렌다이아민(cadmiumethylenediamine, Cadoxen), N-메틸모르폴린 N-옥사이드, 염화 리튬/다이메틸아세트아마이드에 용해된다.[22] 이것은 용해된 펄프로부터 재생 셀룰로스(예: 비스코스 및 셀로판)를 생성하는데 사용된다. 또한 셀룰로스는 많은 종류의 이온성 액체에 용해된다.[23]
셀룰로스는 결정성 및 비결정성 부위로 구성된다. 강산으로 처리함으로서, 비결정성 부위가 분해될 수 있고, 이로 인해 많은 바람직한 특성을 가진 새로운 물질인 나노셀룰로스를 생성할 수 있다.[24] 최근에 나노셀루로스는 우수한 열적, 기계적 특성을 가진 나노복합체를 생성하기 위해 바이오 기반의 중합체 매트릭스에 필러층으로 사용되었다.[25]
가공
[편집]분석
[편집]셀룰로스 함유 물질을 고려할 때, 20 °C에서 17.5% 수산화 나트륨 용액에 용해되지 않는 탄수화물 부분은 α-셀룰로스이며, 이는 진정한 셀룰로스이다. 추출물의 산성화는 β-셀룰로스를 침전시킨다. 염기에 용해되지만 산으로 침전되지 않는 부분은 γ-셀룰로스이다.
셀룰로스는 1969년 업드그라프(Updegraff)가 기술한 방법을 사용하여 분석될 수 있는데, 여기서 섬유질은 리그닌, 헤미셀룰로스, 자일로산을 제거하기 위해 아세트산 및 질산에 용해된다. 생성된 셀룰로스는 황산에서 안트론과 반응할 수 있다. 생성된 착색 화합물을 약 635 nm 파장에서 분광광도법으로 분석한다.
또한 셀룰로스는 산성 세제 섬유와 산성 세제 리그닌의 차이로 나타난다.
또한 발광 접합된 올리고티오펜(oligothiophene)은 형광 현미경 또는 형광분석법을 사용하여 셀룰로스를 검출하는데 사용될 수도 있다.[26]
생합성
[편집]식물에서 셀룰로스는 로제트 말단 복합체(rosette terminal complexes, RTCs)에 의해 세포막에서 합성된다. 로제트 말단 복합체는 개개의 셀룰로스 사슬을 합성하는 셀룰로스 생성효소(cellulose synthase)를 포함하는 약 25 nm 직경의 헥사머 단백질 구조이다.[27] 각각의 로제트 말단 복합체는 세포막에 떠 있고, 세포벽으로 미세섬유(microfibril)를 회전시킨다.
로제트 말단 복합체는 미지의 화학양론에서 CesA 유전자에 의해 발현되는 적어도 세 가지 다른 셀룰로스 생성효소를 포함한다.[28] CesA 유전자의 분리된 세트는 1차 세포벽 및 2차 세포벽의 생합성에 관여한다. CesA 상과(superfamily)에는 약 7개의 아과(subfamily)가 있는 것으로 알려져 있다. 셀룰로스 생성효소는 UDP-포도당을 사용하여 β(1→4) 글리코사이드 결합으로 연결된 셀룰로스를 생성한다.[29]
셀룰로스 합성은 사슬의 개시와 신장이 필요하며, 두 과정은 별개이다. CesA 글루코실트랜스퍼레이스(CesA glucosyltransferase)는 스테로이드 프라이머, β-시토스테롤-β-글루코사이드(β-sitosterol-β-glucoside), UDP-포도당을 사용하여 셀룰로스 중합을 개시한다.[30] 셀룰로스 생성효소는 UDP-포도당 전구체를 사용하여 성장하는 셀룰로스 사슬을 신장시킨다. 셀룰레이스는 성숭한 사슬에서 프라이머를 잘라내는 기능을 갖고 있다.
셀룰로스는 미삭동물(tunicate)에 의해 특히 해초강에서 합성된다(셀룰로스는 역사적으로 "tunicine (tunicin)"으로 불렸었다).[31]
분해 (효소적 분해)
[편집]셀룰로스의 분해는 셀룰로스를 셀로덱스트린이라 불리는 작은 다당류로 분해하거나 포도당 단위체로 완전하게 분해하는 과정으로 가수분해 하는 반응이다. 셀룰로스 분자들은 서로 강하게 결합하고 있기 때문에, 셀룰로스 분해는 다른 다당류의 분해와 비교했을 때 상대적으로 힘들다.[32] 그러나 이 과정은 이온성 액체와 같은 적절한 용매에서 크게 강화될 수 있다.[33]
대부분의 포유류들은 셀룰로스와 같은 식이 섬유를 소화할 수 있는 능력이 제한되어 있다. 소와 양 같은 일부 반추동물들은 제일위(rumen)에서 공생하는 혐기성 세균(Cellulomonas 와 같은)을 포함하고 있으며, 이러한 세균은 셀룰로스를 분해할 수 있는 셀룰레이스라고 불리는 효소를 생산한다. 반추동물의 분해 산물들은 세균의 증식을 위해 사용된다. 세균 덩어리는 나중에 반추동물의 소화계(위와 소장)에서 소화된다. 말들은 셀룰로스를 소화시키기 위해 셀룰레이스를 생산하는 공생 세균을 통해 후장(後腸, hindgut)에서 발효시켜 셀룰로스를 먹이로 이용한다. 이와 유사하게 어떤 흰개미들은 후장에 셀룰레이스를 생산하는 특정 편모성 원생동물을 포함하는 반면 다른 흰개미들은 세균을 포함하거나 셀룰레이스를 생성할 수 있다.[34]
셀룰로스의 글리코사이드 결합을 분해하는데 사용되는 효소는 내부에 작용하는 셀룰레이스와 외부에 작용하는 글루코시데이스를 포함하는 글리코시데이스이다. 이러한 효소는 일반적으로 독케린(dockerin)과 탄수화물 결합 모듈을 모함할 수 있는 다효소 복합체(multienzyme complex)의 일부로 분비된다.[35]
분해 (열분해)
[편집]350 °C 이상의 온도에서 셀룰로스는 열분해되어 고체 탄화물질, 증기, 에어로졸, 이산화 탄소와 같은 가스로 분해된다.[36] 바이오 오일이라고 불리는 액체로 응축되는 증기의 최대 수율은 500 °C에서 얻어진다.[37]
반결정성 셀룰로스 중합체는 열분해 온도(350~600 °C)에서 몇 초 내에 반응한다. 이러한 변환은 단 몇 분의 1초 동안 존재하는 액체(중간 액체 셀룰로스(intermediate liquid cellulose) 또는 용융 셀룰로스(molten cellulose)라고 부름)과 함께 고체-액체-기체- 전이를 통해 일어나는 것으로 나타났다.[38] 글리코사이드 결합의 분해는 용융물을 포함하는 2~7개의 단위체로 구성된 짧은 셀룰로스 사슬을 생성한다. 중간 액체 셀룰로스의 증기 버블링은 용융물로부터 유도된 짧은 사슬 무수물 올리고머로 이루어진 에어로졸을 생성한다.[39]
용융된 셀룰로스의 계속적인 분해는 1차 반응을 통해 레보글루코산, 푸란, 피란, 약한 산화제 및 가스와 같은 같은 휘발성 화합물을 생성한다.[40] 두꺼운 셀룰로스 시료 내에서 레보글루코산과 같은 휘발성 화합물은 피란 및 글리콜알데하이드와 같은 약한 산화제를 포함한 휘발성 산물과 2차 반응을 일으킨다.[41]
헤미셀룰로스
[편집]헤미셀룰로스는 육상식물 바이오매스의 약 20%를 차지하는 셀룰로스와 관련된 다당류이다. 셀룰로스와는 대조적으로 헤미셀룰로스는 포도당, 특히 자일로스 뿐만 아니라 만노스, 갈락토스, 람노스 및 아라비노스를 포함한 여러 당류들로부터 유래된다. 헤미셀룰로스는 500~3,000개의 당 단위체의 짧은 사슬로 구성된다.[42] 게다가 헤미셀룰로스는 분지형인 반면 셀룰로스는 비분지형이다.
유도체
[편집]셀룰로스의 하이드록시기(-OH)는 부분적으로 또는 완전하게 다양한 시약과 반응하여 주로 셀룰로스 에스터 및 셀룰로스 에터와 같은 유용한 특성을 갖는 유도체들을 생성할 수 있다. 원칙적으로 현재의 산업 관행에서 항상 그렇지는 않지만, 셀룰로스 중합체는 재생가능한 자원이다.
에스터 유도체는 다음과 같다.
| 셀룰로스 에스터 | 시약 | 예시 | 시약 | R 기 |
|---|---|---|---|---|
| 유기 에스터 | 유기산 | 셀룰로스 아세테이트 | 아세트산과 아세트산 무수물 | H or -(C=O)CH3 |
| 셀룰로스 트라이아세테이트 | 아세트산과 아세트산 무수물 | -(C=O)CH3 | ||
| 셀룰로스 프로피오네이트 | 프로피온산 | H or -(C=O)CH2CH3 | ||
| 셀룰로스 아세테이트 프로피오네이트 (CAP) | 아세트산과 프로피온산 | H or -(C=O)CH3 or -(C=O)CH2CH3 | ||
| 셀룰로스 아세테이트 뷰티레이트 (CAB) | 아세트산과 뷰티르산 | H or -(C=O)CH3 or -(C=O)CH2CH2CH3 | ||
| 무기 에스터 | 무기산 | 나이트로셀룰로스 | 질산 또는 다른 강력한 나이트로화제 | H or -NO2 |
| 황산 셀룰로스 | 황산 또는 다른 강력한 sulfuring agent | H or -SO3H |
셀룰로스 아세테이트 및 셀룰로스 트라이아세테이트는 다양한 용도를 갖는 필름 및 섬유 형성 재료이다. 나이트로셀룰로스는 처음에는 폭발물로 사용되었으며 초기 필름 형성 물질이었다. 장뇌와 함께 나이트로셀룰로스는 셀룰로이드를 제공할 수 있다.
에터 유도체는 다음과 같다.
| 셀룰로스 에터 | 시약 | 예시 | 시약 | R 기 = H 또는 | 물에 대한 용해도 | 활용 | E 번호 |
|---|---|---|---|---|---|---|---|
| 알킬 | 할로알케인 | 메틸셀룰로스 | 클로로메테인 | -CH3 | 찬물에 용해됨 | E461 | |
| 에틸셀룰로스 | 클로로에테인 | -CH2CH3 | 물에 불용성 | 코팅, 잉크, 바인더 및 제어 방출 약물 정제에 사용되는 상업용 열가소성 수지 | E462 | ||
| 에틸메틸셀룰로스 | 클로로메테인과 클로로에테인 | -CH3 or -CH2CH3 | E465 | ||||
| 하이드록시알킬 | 에폭시드 | 하이드록시에틸셀룰로스 | 산화 에틸렌 | -CH2CH2OH | 찬물과 뜨거운 물에 용해됨 | 겔화제 및 증점안정제 | |
| 하이드록시프로필셀룰로스 (HPC) | 산화 프로필렌 | -CH2CH(OH)CH3 | 찬물에 용해됨 | E463 | |||
| 하이드록시에틸메틸셀룰로스 | 클로로메테인과 산화 에틸렌 | -CH3 or -CH2CH2OH | 찬물에 용해됨 | 셀룰로스 필름의 제조 | |||
| 하이드록시프로필메틸셀룰로스 (HPMC) | 클로로메테인과 산화 프로필렌 | -CH3 or -CH2CH(OH)CH3 | 찬물에 용해됨 | 점도 조절제, 겔화제, 발포제, 결합제 | E464 | ||
| 에틸하이드록시에틸셀룰로스 | 클로로에테인과 산화 에틸렌 | -CH2CH3 or—CH2CH2OH | E467 | ||||
| 카복시알킬 | 할로젠화 카복실산 | 카복시메틸셀룰로스 (CMC) | 클로로아세트산 | -CH2COOH | 찬물과 뜨거운 물에 용해됨 | 종종 나트륨염으로 카복시메틸셀룰로스 나트륨(NaCMC)을 사용함 | E466 |
카복시메틸셀룰로스 나트륨은 제약 제제의 부형제로 사용되기 위한 크로스카멜로스 나트륨(E468)을 제공하기 위해 가교를 형성할 수 있다.
활용
[편집]
산업용 셀룰로스는 주로 목재 펄프 및 면화에서 얻어진다.[6] 크라프트법(kraft process)은 식물 물질의 주요 성분인 리그닌과 셀룰로스를 분리하는 공정이다.
- 종이 제품: 셀룰로스는 종이, 판지, 카드 스톡(card stock)의 주요 성분이다.
- 섬유: 셀룰로스는 면, 리넨 및 다른 식물 섬유로 만든 직물의 주요 성분이다. 셀룰로스는 20세기 초부터 직물에 사용되어 온 중요한 섬유인 레이온으로 변환될 수 있다. 셀로판과 레이온 모두 "재생 셀룰로스 섬유"로 알려져 있다. 이들은 화학 구조에서 셀룰로스와 동일하며, 보통 비스코스를 통해 펄프를 용해시켜 만든다. 보다 최근에 환경 친화적인 방법으로 레이온을 만드는 방법은 라이오셀법(Lyocell process)이다.
- 소모품: 마이크로크리스탈린셀룰로스(E460i)와 분말셀룰로스(E460ii)는 약물 정제에서 비활성 부형제로 사용되며,[43] 다양한 수용성 셀룰로스 유도체인 E 번호 E461~E469는 가공식품에서 유화제, 증점안정제 및 안정제로 사용된다. 예를 들어 셀룰로스 분말은 포장된 치즈의 고화(固化)를 방지하기 위해 사용된다. 셀룰로스는 일부 식품에 자연적으로 존재하며 제조된 식품의 부피와 질감을 위해 첨가제로 사용되는 소화가 되지 않는 성분으로 잠재적으로 배변 활동을 돕는데 기여한다.[44]
- 과학: 셀룰로스는 실험실에서 박층 크로마토그래피의 고정상으로 사용된다. 셀룰로스 섬유는 또한 액체 여과에도 사용되며, 때로는 규조토 또는 다른 여과 매체와 조합하여 비활성 물질의 여과대를 만드는데 이용된다.
- 에너지 작물: 비식용 에너지 작물의 주된 가연성 성분은 셀룰로스이며, 리그닌은 그 다음이다. 비식용 에너지 작물은 식용 에너지 작물(녹말 성분이 많음)보다 더 많은 가용 에너지를 생산하지만, 여전히 농업 용지와 수자원을 두고 식용 작물과 경쟁한다.[45] 전형적인 비식용 에너지 작물에는 산업용 삼(일부 국가에서는 불법임), 지팽이풀(switchgrass) 억새, 버드나무, 사시나무 종들이 포함된다.
- 바이오연료: 얼룩말 노폐물에서 발견되는 클로스트리디움(Clostridium) 세균의 균주인 TU-103은 거의 모든 형태의 셀룰로스를 뷰탄올 연료로 전환시킬 수 있다.[46][47]
- 건축 재료: 물에서 셀룰로스의 하이드록시기의 결합은 플라스틱 및 레진의 사용에 대한 대안으로 스프레이가 가능한 성형 가능 물질을 생성할 수 있게 한다. 재활용이 가능한 재료는 방수성 및 방화성을 나타낼 수 있다. 셀룰로스는 건축 재료로 사용할 수 있는 충분한 강도를 제공한다.[48] 재활용 종이로 만든 셀룰로스 단열재는 건물 단열을 위한 환경적으로 바람직한 소재로 널리 보급되고 있다. 이것은 방염(防炎)을 위해 붕산으로 처리될 수 있다.
- 기타: 셀룰로스는 얇고 투명한 필름인 셀로판으로 전환될 수 있다. 셀룰로스는 1930년대 중반까지 사진 및 영화 필름에 사용된 셀룰로이드의 기본 재료이다. 셀룰로스는 벽지 접착제에 사용되는 메틸셀룰로스 및 카복시메틸셀룰로스와 같은 수용성 접착제 및 결합제를 제조하는데 사용된다. 또한 셀룰로스는 친수성 및 흡습성이 높은 스펀지를 만드는데 사용된다. 셀룰로스는 무연 화약에 사용되는 나이트로셀룰로스(질산 셀룰로스)의 제조의 원료이다.
- 제약: 마이크로크리스탈린셀룰로스와 같은 셀룰로스 유도체는 수분을 보유하고, 안정제 및 증점안정제가 되고, 약물 정제를 강화하는 이점을 가지고 있다.[49]
같이 보기
[편집]각주
[편집]- ↑ Nishiyama, Yoshiharu; Langan, Paul; Chanzy, Henri (2002). “Crystal Structure and Hydrogen-Bonding System in Cellulose Iβ from Synchrotron X-ray and Neutron Fiber Diffraction”. 《J. Am. Chem. Soc.》 124 (31): 9074–82. doi:10.1021/ja0257319. PMID 12149011.
- ↑ 가 나 다 라 NIOSH Pocket Guide to Chemical Hazards. “#0110”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ 가 나 Crawford, R. L. (1981). 《Lignin biodegradation and transformation》. New York: John Wiley and Sons. ISBN 0-471-05743-6.
- ↑ Updegraff DM (1969). “Semimicro determination of cellulose in biological materials”. 《Analytical Biochemistry》 32 (3): 420–424. doi:10.1016/S0003-2697(69)80009-6. PMID 5361396.
- ↑ Romeo, Tony (2008). 《Bacterial biofilms》. Berlin: Springer. 258–263쪽. ISBN 978-3-540-75418-3.
- ↑ 가 나 다 라 마 Klemm, Dieter; Heublein, Brigitte; Fink, Hans-Peter; Bohn, Andreas (2005). “Cellulose: Fascinating Biopolymer and Sustainable Raw Material”. 《Angew. Chem. Int. Ed.》 44 (22): 3358–93. doi:10.1002/anie.200460587. PMID 15861454.
- ↑ 가 나 Neil A. Campbell, Jane B. Reece, 《Biology 8th edition》, BenjaminCummings, 2007.11.27
- ↑ Cellulose. (2008). In Encyclopædia Britannica. Retrieved January 11, 2008, from Encyclopædia Britannica Online.
- ↑ Chemical Composition of Wood Archived 2018년 10월 13일 - 웨이백 머신. ipst.gatech.edu.
- ↑ Piotrowski, Stephan and Carus, Michael (May 2011) Multi-criteria evaluation of lignocellulosic niche crops for use in biorefinery processes Archived 2021년 4월 3일 - 웨이백 머신. nova-Institut GmbH, Hürth, Germany.
- ↑ Taiz, Lincoln, Zeiger, Eduardo, 《Plant Physiology 4th Edition》, Sinauer Associates, 2006.07.01
- ↑ Payen, A. (1838) "Mémoire sur la composition du tissu propre des plantes et du ligneux" (Memoir on the composition of the tissue of plants and of woody [material]), Comptes rendus, vol. 7, pp. 1052–1056. Payen added appendices to this paper on December 24, 1838 (see: Comptes rendus, vol. 8, p. 169 (1839)) and on February 4, 1839 (see: Comptes rendus, vol. 9, p. 149 (1839)). A committee of the French Academy of Sciences reviewed Payen's findings in : Jean-Baptiste Dumas (1839) "Rapport sur un mémoire de M. Payen, relatif à la composition de la matière ligneuse" (Report on a memoir of Mr. Payen, regarding the composition of woody matter), Comptes rendus, vol. 8, pp. 51–53. In this report, the word "cellulose" is coined and author points out the similarity between the empirical formula of cellulose and that of "dextrine" (starch). The above articles are reprinted in: Brongniart and Guillemin, eds., Annales des sciences naturelles ..., 2nd series, vol. 11 (Paris, France: Crochard et Cie., 1839), pp. 21–31.
- ↑ Young, Raymond (1986). 《Cellulose structure modification and hydrolysis》. New York: Wiley. ISBN 0-471-82761-4.
- ↑ Kobayashi, Shiro; Kashiwa, Keita; Shimada, Junji; Kawasaki, Tatsuya; Shoda, Shin-ichiro (1992). “Enzymatic polymerization: The first in vitro synthesis of cellulose via nonbiosynthetic path catalyzed by cellulase”. 《Makromolekulare Chemie. Macromolecular Symposia》. 54–55 (1): 509–518. doi:10.1002/masy.19920540138.
- ↑ Bishop, Charles A., 편집. (2007). 《Vacuum deposition onto webs, films, and foils》. 165쪽. ISBN 0-8155-1535-9.
- ↑ Dauenhauer, Paul; Krumm, Christoph; Pfaendtner, Jim (2016). “Millisecond Pulsed Films Unify the Mechanisms of Cellulose Fragmentation”. 《Chemistry of Materials》 28 (1): 0001. doi:10.1021/acs.chemmater.6b00580.
- ↑ Wymer, Charles E. (1994). “Ethanol from lignocellulosic biomass: Technology, economics, and opportunities”. 《Bioresource Technology》 50 (1): 5. doi:10.1016/0960-8524(94)90214-3. 2016년 10월 28일에 확인함.
- ↑ Sturcova et al. 2004
- ↑ Deguchi, Shigeru; Tsujii, Kaoru; Horikoshi, Koki (2006). “Cooking cellulose in hot and compressed water”. 《Chemical Communications》 (31): 3293. doi:10.1039/b605812d.
- ↑ Structure and morphology of cellulose 보관됨 4월 26, 2009 - 웨이백 머신 by Serge Pérez and William Mackie, CERMAV-CNRS, 2001. Chapter IV.
- ↑ “Chapter 2: Chemical Composition and Structure of Natural Lignocellulose” (PDF). 2017년 10월 31일에 원본 문서 (PDF)에서 보존된 문서. 2019년 1월 21일에 확인함.
- ↑ Stenius, Per (2000). 〈Ch. 1〉. 《Forest Products Chemistry》. Papermaking Science and Technology. Vol. 3. Finland: Fapet OY. 35쪽. ISBN 952-5216-03-9.
- ↑ Wang, Hui; Gurau, Gabriela; Rogers, Robin D. (2012). “Ionic liquid processing of cellulose”. 《Chemical Society Reviews》 41 (4): 1519–37. doi:10.1039/C2CS15311D. PMID 22266483.
- ↑ Peng, B. L.; Dhar, N.; Liu, H. L.; Tam, K. C. (2011). “Chemistry and applications of nanocrystalline cellulose and its derivatives: A nanotechnology perspective” (PDF). 《The Canadian Journal of Chemical Engineering》 89 (5): 1191–1206. doi:10.1002/cjce.20554. 2016년 10월 24일에 원본 문서 (PDF)에서 보존된 문서. 2019년 1월 21일에 확인함.
- ↑ Pranger, L.; Tannenbaum, R. (2008). “Biobased Nanocomposites Prepared by in Situ Polymerization of Furfuryl Alcohol with Cellulose Whiskers or Montmorillonite Clay”. 《Macromolecules》 41 (22): 8682–8687. doi:10.1021/ma8020213.
- ↑ Choong, Ferdinand X.; Bäck, Marcus; Steiner, Svava E.; Melican, Keira; Nilsson, K. Peter R.; Edlund, Ulrica; Richter-Dahlfors, Agneta (2016년 10월 19일). “Nondestructive, real-time determination and visualization of cellulose, hemicellulose and lignin by luminescent oligothiophenes”. 《Scientific Reports》 6: 35578. doi:10.1038/srep35578. PMID 27759105. 2016년 10월 19일에 확인함.
- ↑ Kimura, S; Laosinchai, W; Itoh, T; Cui, X; Linder, CR; Brown Jr, RM (1999). “Immunogold labeling of rosette terminal cellulose-synthesizing complexes in the vascular plant vigna angularis”. 《The Plant Cell》 11 (11): 2075–86. doi:10.2307/3871010. JSTOR 3871010. PMC 144118. PMID 10559435.
- ↑ Taylor, N. G. (2003). “Interactions among three distinct CesA proteins essential for cellulose synthesis”. 《Proceedings of the National Academy of Sciences》 100 (3): 1450–1455. doi:10.1073/pnas.0337628100. PMC 298793. PMID 12538856.
- ↑ Richmond, Todd A; Somerville, Chris R (October 2000). “The Cellulose Synthase Superfamily”. 《Plant Physiology》 124 (2): 495–498. doi:10.1104/pp.124.2.495. PMC 1539280. PMID 11027699. 2014년 12월 14일에 확인함.
- ↑ Peng, L; Kawagoe, Y; Hogan, P; Delmer, D (2002). “Sitosterol-beta-glucoside as primer for cellulose synthesis in plants”. 《Science》 295 (5552): 147–50. doi:10.1126/science.1064281. PMID 11778054.
- ↑ Endean, R (1961). “The Test of the Ascidian, Phallusia mammillata” (PDF). 《Quarterly Journal of Microscopical Science》 102 (1): 107–117.
- ↑ Barkalow, David G.; Whistler, Roy L. (2014). “Cellulose”. 《AccessScience》. doi:10.1036/1097-8542.118200.
- ↑ Ignatyev, Igor; Doorslaer, Charlie Van; Mertens, Pascal G.N.; Binnemans, Koen; Vos, Dirk. E. de (2011). “Synthesis of glucose esters from cellulose in ionic liquids”. 《Holzforschung》 66 (4): 417–425. doi:10.1515/hf.2011.161.
- ↑ Tokuda, G; Watanabe, H (2007년 6월 22일). “Hidden cellulases in termites: revision of an old hypothesis”. 《Biology Letters》 3 (3): 336–339. doi:10.1098/rsbl.2007.0073. PMC 2464699. PMID 17374589.
- ↑ Brás, Natércia (2008). “Carbohydrate Binding Modules from family 11: Understanding the binding mode of polysaccharides”. 《International Journal of Quantum Chemistry》 108 (11): 2030–2040. doi:10.1002/qua.21755.
- ↑ Mettler, Matthew S.; Vlachos, Dionisios G.; Dauenhauer, Paul J. (2012). “Top Ten Fundamental Challenges of Biomass Pyrolysis for Biofuels”. 《Energy & Environmental Science》 5 (7): 7797. doi:10.1039/C2EE21679E.
- ↑ Czernik, S.; Bridgwater, A. V. (2004). “Overview of Applications of Biomass Fast Pyrolysis Oil”. 《Energy & Fuels》 (Energy & Fuels, American Chemical Society) 18 (2): 590–598. doi:10.1021/ef034067u.
- ↑ Dauenhauer, Paul J.; Colby, Joshua L.; Balonek, Christine M.; Suszynski, Wieslaw J.; Schmidt, Lanny D. (2009). “Reactive Boiling of Cellulose for Integrated Catalysis through an Intermediate Liquid”. 《Green Chemistry》 11 (10): 1555. doi:10.1039/B915068B.
- ↑ Teixeira, Andrew R.; Mooney, Kyle G.; Kruger, Jacob S.; Williams, C. Luke; Suszynski, Wieslaw J.; Schmidt, Lanny D.; Schmidt, David P.; Dauenhauer, Paul J. (2011). “Aerosol Generation by Reactive Boiling Ejection of Molten Cellulose”. 《Energy & Environmental Science》 (Energy & Environmental Science, Royal Society of Chemistry) 4 (10): 4306. doi:10.1039/C1EE01876K.
- ↑ Mettler, Matthew S.; Mushrif, Samir H.; Paulsen, Alex D.; Javadekar, Ashay D.; Vlachos, Dionisios G.; Dauenhauer, Paul J. (2012). “Revealing pyrolysis chemistry for biofuels production: Conversion of cellulose to furans and small oxygenates”. 《Energy Environ. Sci.》 5: 5414–5424. doi:10.1039/C1EE02743C.
- ↑ Mettler, Matthew S.; Paulsen, Alex D.; Vlachos, Dionisios G.; Dauenhauer, Paul J. (2012). “Pyrolytic Conversion of Cellulose to Fuels: Levoglucosan Deoxygenation via Elimination and Cyclization within Molten Biomass”. 《Energy & Environmental Science》 5 (7): 7864. doi:10.1039/C2EE21305B.
- ↑ Gibson LJ (2013). “The hierarchical structure and mechanics of plant materials”. 《Journal of the Royal Society Interface》 9 (76): 2749–2766. doi:10.1098/rsif.2012.0341. PMC 3479918. PMID 22874093.
- ↑ Weiner, Myra L.; Kotkoskie, Lois A. (2000). 《Excipient Toxicity and Safety》. New York: Dekker. 210쪽. ISBN 978-0-8247-8210-8.
- ↑ Dhingra, D; Michael, M; Rajput, H; Patil, R. T. (2011). “Dietary fibre in foods: A review”. 《Journal of Food Science and Technology》 49 (3): 255–266. doi:10.1007/s13197-011-0365-5. PMC 3614039. PMID 23729846.
- ↑ Holt-Gimenez, Eric (2007). Biofuels: Myths of the Agrofuels Transition. Backgrounder. Institute for Food and Development Policy, Oakland, CA. 13:2 “Archived copy”. 2013년 9월 5일에 원본 문서에서 보존된 문서. 2013년 9월 5일에 확인함. “Archived copy”. 2013년 9월 6일에 원본 문서에서 보존된 문서. 2013년 9월 5일에 확인함.
- ↑ Hobgood Ray, Kathryn (2011년 8월 25일). “Cars Could Run on Recycled Newspaper, Tulane Scientists Say”. 《Tulane University news webpage》. Tulane University. 2014년 10월 21일에 원본 문서에서 보존된 문서. 2012년 3월 14일에 확인함.
- ↑ Balbo, Laurie (2012년 1월 29일). “Put a Zebra in Your Tank: A Chemical Crapshoot?”. Greenprophet.com. 2012년 11월 17일에 확인함.
- ↑ “Zeoform: The eco-friendly building material of the future?”. Gizmag.com. 2013년 8월 30일에 확인함.
- ↑ Thoorens, G; Krier, F; Leclercq, B; Carlin, B; Evrard, B (2014). “Microcrystalline cellulose, a direct compression binder in a quality by design environment--a review”. 《International Journal of Pharmaceutics》 473 (1–2): 64–72. doi:10.1016/j.ijpharm.2014.06.055. PMID 24993785.
외부 링크
[편집] 위키미디어 공용에 셀룰로스 관련 미디어 분류가 있습니다.
위키미디어 공용에 셀룰로스 관련 미디어 분류가 있습니다. 〈Cellulose〉. 《브리태니커 백과사전》 5 11판. 1911.
〈Cellulose〉. 《브리태니커 백과사전》 5 11판. 1911.- Structure and morphology of cellulose by Serge Pérez and William Mackie, CERMAV-CNRS
- Cellulose, by Martin Chaplin, London South Bank University
- Clear description of a cellulose assay method at the Cotton Fiber Biosciences unit of the USDA.
- Cellulose films could provide flapping wings and cheap artificial muscles for robots – TechnologyReview.com
- CDC - NIOSH Pocket Guide to Chemical Hazards - Cellulose

