17-Hidroxiproxesterona
| 17-Hidroxiproxesterona | |
|---|---|
 | |
 | |
17α-Hidroxipregn-4-eno-3,20-diona | |
(1R,3aS,3bR,9aR,9bS,11aS)-1-Acetil-1-hidroxi-9a,11a-dimetil-1,2,3,3a,3b,4,5,8,9,9a,9b,10,11,11a-tetradecahidro-7H-ciclopenta[a]fenantren-7-ona | |
Outros nomes Hidroxiproxesterona (DCI) | |
| Identificadores | |
| Número CAS | 68-96-2 |
| PubChem | 6238 |
| ChemSpider | 6002 |
| UNII | 21807M87J2 |
| ChEBI | CHEBI:17252 |
| ChEMBL | CHEMBL1062 |
| Ligando IUPHAR | 5104 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C21H30O3 |
| Masa molecular | 330,46 g/mol |
| Punto de fusión | 219,5 |
| Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
A 17-hidroxiproxesterona (nome DCI xenérico hidroxiproxesterona, OHP[1][2][3]), tamén chamada 17α-hidroxiproxesterona (17α-OHP) e 17-OH proxesterona (17-OHP),[4] é unha hormona esteroide proxestáxena endóxena relacionada coa proxesterona.[1][2][3] É tamén un intermediario químico na biosíntese de moitos outros esteroides endóxenos, incluíndo andróxenos, estróxenos, glicocorticoides e mineralocorticoides, así como neuroesteroides.
Actividade biolóxica
[editar | editar a fonte]A 17α-OHP é un agonista do receptor da proxesterona (PR) similar á proxesterona, pero máis débil en comparación.[5] Ademais, é un antagonista do receptor de mineralocorticoides (MR)[6] así como un agonista parcial do receptor de glicocorticoides (GR), aínda que con moi baixa potencia (EC50 >100 veces menos en relación ao cortisol) neste último sitio, tamén de xeito similar á proxesterona.[5][7][8]
| Composto | hPR-A | hPR-B | rbPR | rbGR | rbER | |||
|---|---|---|---|---|---|---|---|---|
| Proxesterona | 100 | 100 | 100 | <1 | <1 | |||
| 17α-Hidroxiproxesterona | 1 | 1 | 3 | 1 | <1 | |||
| Hidroxiproxesterona caproato | 26 | 30 | 28 | 4 | <1 | |||
| Hidroxiproxesterona acetato | 38 | 46 | 115 | 3 | ? | |||
| Notas: Os valores son porcentaxes (%). Os ligandos de referencia (100%) foron proxesterona para o PR, dexametasona para o GR e estradiol para o ER. Fontes: Ver modelo. | ||||||||
Bioquímica
[editar | editar a fonte]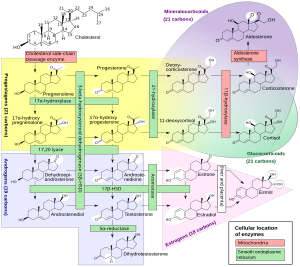
Biosíntese
[editar | editar a fonte]A 17α-OHP deriva da proxesterona por acción do encima 17α-hidroxilase (codificada por CYP17A1)[9]
Os niveis de 17α-OHP increméntanse no terceiro trimestre de embarazo debido primeiramente á produción adrenal fetal.[Cómpre referencia]
Este esteroide prodúcese principalmente nas glándulas adrenais e en certo grao nas gónadas, concretamente no corpo lúteo do ovario. Os niveis normais son 3-90 ng/dl en nenos e, en mulleres, 20-100 ng/dl antes da ovulación, e 100-500 ng/dl durante a fase lútea.[10][11]
Medida
[editar | editar a fonte]As medidas dos niveis de 17α-OHP son útiles na avaliación de pacientes con sospeitas de hiperplasia adrenal conxénita, xa que nela a deficiencia nos encimas típicos, concretamente a 21-hidroxilase e a 11β-hidroxilase, orixina unha acumulación de 17α-OHP. En contraste, os raros pacientes con deficiencia de 17α-hidroxilase teñen uns niveis moi baixos ou indetectables de 17α-OHP.[12] Os niveis de 17α-OHP poden tamén utilizarse para medir a contribución da actividade proxestacional do corpo lúteo durante o embarazo como proxesterona, pero a 17α-OHP tamén se produce na placenta.[Cómpre referencia]
Os inmunoensaios como o RIA (radioinmunoensaio) ou o IRMA (ensaio inmunorradiométrico) usados para determinar clinicamente a 17α-OHP teñen tendencia ás reaccións cruzadas cos precursores esteroides da 17α-OHP e os seus conxugados sulfatados. As cromatografías de gas ou líquida e a espectrometría de masas (por exemplo a LC-MS/MS) conseguen unha maior especificidade que os inmunoensaios.[13][14]
As medidas de 17α-OHP por LC-MS/MS mellora os cribados do neonato para a hiperplasia adrenal conxénita debido a deficiencia de 21-hidroxilase, porque os precursores esteroides da 17α-OHP e ao seus conxugados sulfatados que están presentes nos primeiros dous días despois do nacemento e máis tempo nos neonatos pretérmino, presentan reaccións cruzadas en inmunoensaios coa 17α-OHP, dando falsamente altos niveis de 17α-OHP.[13][14]
Farmacocinética
[editar | editar a fonte]Aínda que a 17α-OHP non se utilizou como medicamento, a súa farmacocinética foi estudada e revisada.[15]
Usos médicos
[editar | editar a fonte]Os ésteres da 17α-OHP, como a hidroxiproxesterona caproato e, en moita menor medida, a hidroxiproxesterona acetato e a hidroxiproxesterona heptanoato, utilizáronse en medicina como proxestinas.[1][2][3] Normalmente cando se fai referencia á "hidroxiproxesterona" no seu uso médico como medicamento, xeralmente se está facendo referencia ao seu derivado hidroxiproxesterona caproato.[Cómpre referencia]
Química
[editar | editar a fonte]A 17α-OHP, tamén chamada 17α-hidroxipregn-4-eno-3,20-diona, é un esteroide pregnano natural. Presenta un grupo cetona nas posicións C3 e C20, un grupo hidroxilo na poición C17α e un dobre enlace entre as posicións C4 e C5.[Cómpre referencia]
A 17α-OHP é o composto parental dunha clase de proxestinas denominada derivados da 17α-hidroxiproxesterona.[16][17][18] Entre outros, esta clase de fármacos inclúe os seguintes: clormadinona acetato, ciproterona acetto, hidroxiproxesterona caproato, medroxiproxesterona acetato e mexestrol acetato.[16][17][18]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 J. Elks (14 de novembro de 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 664–665. ISBN 978-1-4757-2085-3.
- ↑ 2,0 2,1 2,2 I.K. Morton; Judith M. Hall (6 decembro de 2012). Concise Dictionary of Pharmacological Agents: Properties and Synonyms. Springer Science & Business Media. pp. 146–. ISBN 978-94-011-4439-1.
- ↑ 3,0 3,1 3,2 Index Nominum 2000: International Drug Directory. Taylor & Francis. xaneiro de 2000. pp. 532–. ISBN 978-3-88763-075-1.
- ↑ "17-hydroxyprogesterone (17OHP)".
- ↑ 5,0 5,1 Attardi BJ, Zeleznik A, Simhan H, Chiao JP, Mattison DR, Caritis SN (2007). "Comparison of progesterone and glucocorticoid receptor binding and stimulation of gene expression by progesterone, 17-alpha hydroxyprogesterone caproate, and related progestins". Am. J. Obstet. Gynecol. 197 (6): 599.e1–7. PMC 2278032. PMID 18060946. doi:10.1016/j.ajog.2007.05.024.
- ↑ Mooij CF, Parajes S, Pijnenburg-Kleizen KJ, Arlt W, Krone N, Claahsen-van der Grinten HL (abril de 2015). "Influence of 17-Hydroxyprogesterone, Progesterone and Sex Steroids on Mineralocorticoid Receptor Transactivation in Congenital Adrenal Hyperplasia" (PDF). Horm Res Paediatr 83 (6): 414–421. PMID 25896481. doi:10.1159/000374112.
- ↑ Pijnenburg-Kleizen KJ, Engels M, Mooij CF, Griffin A, Krone N, Span PN, van Herwaarden AE, Sweep FC, Claahsen-van der Grinten HL (2015). "Adrenal Steroid Metabolites Accumulating in Congenital Adrenal Hyperplasia lead to Transactivation of the Glucocorticoid Receptor". Endocrinology 156 (10): 3504–3510. PMID 26207344. doi:10.1210/en.2015-1087.
- ↑ Sun, Kang; Lei, Kaiyu; Chen, Li; Georgiou, Ektoras X.; Sooranna, Suren R.; Khanjani, Shirin; Brosens, Jan J.; Bennett, Phillip R.; Johnson, Mark R. (2012). "Progesterone Acts via the Nuclear Glucocorticoid Receptor to Suppress IL-1β-Induced COX-2 Expression in Human Term Myometrial Cells". PLOS ONE 7 (11): e50167. Bibcode:2012PLoSO...750167L. ISSN 1932-6203. PMC 3509141. PMID 23209664. doi:10.1371/journal.pone.0050167.
- ↑ "CYP17A1 cytochrome P450 family 17 subfamily A member 1 [Homo sapiens (human) ] - Gene - NCBI". www.ncbi.nlm.nih.gov. Retrieved 2016-09-27.
- ↑ Reference Values During Pregnancy
- ↑ "normal ranges for hormone tests in women". Arquivado dende o orixinal o 2020-11-08. Consultado o 2011-08-07.
- ↑ Modelo:Phyllis W. Speiser e Perrin C. White. Congenital Adrenal Hyperplasia (21 de agosto de 2003). N Engl J Med 2003; 349:776-788. DOI: 10.1056/NEJMra021561
- ↑ 13,0 13,1 de Hora MR, Heather NL, Patel T, Bresnahan LG, Webster D, Hofman PL (marzo de 2020). "Measurement of 17-Hydroxyprogesterone by LCMSMS Improves Newborn Screening for CAH Due to 21-Hydroxylase Deficiency in New Zealand". International Journal of Neonatal Screening 6 (1): 6. PMC 7422986. PMID 33073005. doi:10.3390/ijns6010006.
- ↑ 14,0 14,1 Bialk ER, Lasarev MR, Held PK (setembro de 2019). "Wisconsin's Screening Algorithm for the Identification of Newborns with Congenital Adrenal Hyperplasia". International Journal of Neonatal Screening 5 (3): 33. PMC 7510207. PMID 33072992. doi:10.3390/ijns5030033.
- ↑ Die Gestagene. Springer-Verlag. 27 de novembro de 2013. pp. 276–277. ISBN 978-3-642-99941-3.
- ↑ 16,0 16,1 Jeffrey K. Aronson (21 de febreiro de 2009). Meyler's Side Effects of Endocrine and Metabolic Drugs. Elsevier. pp. 289–. ISBN 978-0-08-093292-7.
- ↑ 17,0 17,1 Robert Alan Prentky; Ann Wolbert Burgess (31 de xullo de 2000). Forensic Management of Sexual Offenders. Springer Science & Business Media. pp. 219–. ISBN 978-0-306-46278-8.
- ↑ 18,0 18,1 H. J. Smith; Hywel Williams (1 de xaneiro de 1983). Introduction to the Principles of Drug Design. Elsevier. pp. 187–. ISBN 978-1-4831-8350-3.
