2-propanol
| 2-propanol | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
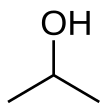
| ||||
Structuurformule van 2-propanol
| ||||

| ||||
Molecuulmodel van 2-propanol
| ||||
| Algemeen | ||||
| Molecuulformule | C3H8O | |||
| IUPAC-naam | propaan-2-ol | |||
| Andere namen | 2-hydroxypropaan, isopropanol, isopropylalcohol, IPA | |||
| Molmassa | 60,09 g/mol | |||
| SMILES | CC(O)C
| |||
| InChI | 1S/C3H7OH/c1-3(2)4/h3-4H,1-2H3
| |||
| CAS-nummer | 67-63-0 | |||
| EG-nummer | 200-661-7 | |||
| Wikidata | Q16392 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H225 - H319 - H336 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P102 - P210 - P262 - P301+P330+P331 - P403 - P305+P351+P338 | |||
| LD50 (ratten) | (oraal) > 5000 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 0,785 g/cm³ | |||
| Smeltpunt | −89 °C | |||
| Kookpunt | 82 °C | |||
| Vlampunt | 12 °C | |||
| Goed oplosbaar in | water, methanol, aceton, benzeen, chloroform | |||
| log(Pow) | 0,16 | |||
| Viscositeit | 0,00196 Pa·s | |||
| Brekingsindex | 1,37927 | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 1,66 D | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
2-propanol, ook aangeduid als propaan-2-ol (IUPAC-naam), isopropanol, isopropylalcohol en afgekort tot IPA, is een secundair alcohol met als brutoformule C3H8O. In zuivere toestand is het een kleurloze en heldere vloeistof met een relatief zoete geur, die zeer goed oplosbaar is in zowel water als een aantal organische oplosmiddelen. Door het snelle verdampen en het goede oplossen van vettigheid heeft 2-propanol een breed scala aan toepassingen, voornamelijk als ontsmettingsmiddel. Bovendien tast de stof kunststoffen en printplaten niet aan.
Synthese
[bewerken | brontekst bewerken]2-propanol wordt industrieel bereid door de additie van water aan propeen, onder de invloed van een zure katalysator:
Een alternatieve route is de reductie van aceton met waterstofgas, of andere reductoren zoals lithiumaluminiumhydride.
Eigenschappen
[bewerken | brontekst bewerken]2-propanol vormt als oplossing in water (12,1%) een azeotroop die kookt bij 80,4°C. Ook met verschillende andere organische oplosmiddelen, waaronder n-pentaan, n-hexaan, n-heptaan, n-octaan, cyclohexaan, benzeen en tolueen, worden azeotropen gevormd.
Toepassingen
[bewerken | brontekst bewerken]2-propanol kent diverse toepassingen. In de gezondheidszorg wordt het hoofdzakelijk als ontsmettingsmiddel gebruikt, meestal verwerkt in een gel.[1]
Het is een veelgebruikt huishoudelijk oplosmiddel, bijvoorbeeld voor het schoonmaken van brillenglazen. In meer gespecialiseerde toepassingen wordt het gebruikt voor het reinigen van drukvlakken in de grafische industrie en van siliciumwafers in de chipindustrie.
In de biochemie en moleculaire biologie wordt 2-propanol gebruikt om DNA te precipiteren.
2-propanol is een koelmiddel voor CNC-gestuurde hogesnelheidsfrezen, en een oplosmiddel in de koelgassen-industrie.
Om ethanol ongeschikt te maken voor menselijke consumptie, wordt er 1 tot 3% 2-propanol aan toegevoegd, of methanol. Dit proces wordt denaturatie genoemd.
In thanatopraxie wordt 2-propanol toegepast als balsemvloeistof.
Toxicologie en veiligheid
[bewerken | brontekst bewerken]2-propanol kan bij langdurige blootstelling effecten op het zenuwstelsel en uitdroging van de huid veroorzaken. Het gebruik van tatoe-inkten met isopropanol is sinds 4 januari 2022 in de Europese Unie verboden.[2][3]
2-propanol is vluchtig en ontvlambaar. De stof kan, onder invloed van zuurstofgas, ontplofbare peroxiden vormen.
Externe link
[bewerken | brontekst bewerken]- (en) Gegevens van 2-propanol in de GESTIS-stoffendatabank van het IFA
- ↑ Shell schroeft productie grondstof handgel 'substantieel' op. Gearchiveerd op 20 januari 2022.
- ↑ Europa verbiedt huidige tatoeage-inkt vanaf 2022: tatoeëerders in zak en as. Het Laatste Nieuws (8 oktober 2021). Gearchiveerd op 28 oktober 2021. Geraadpleegd op 11 oktober 2021.
- ↑ (en) Tattoo inks and permanent make-up. ECHA. Gearchiveerd op 19 oktober 2021. Geraadpleegd op 11 oktober 2021.



