4-Chlorbenzylchlorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
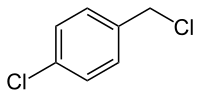
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Chlorbenzylchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H6Cl2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser bis gelblicher Feststoff mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 161,03 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,27 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
220,6 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
4-Chlorbenzylchlorid ist eine chemische Verbindung und ein Derivat von Benzylchlorid.
Darstellung
[Bearbeiten | Quelltext bearbeiten]4-Chlorbenzylchlorid kann durch Licht-aktivierte radikalische Substitution von 4-Chlortoluol erhalten werden, was allerdings die Gefahr eines Chlorfeuers birgt.

Eine besser kontrollierbare Laborsynthese verläuft daher unter Benutzung von Sulfurylchlorid als Chlorierungsmittel und AIBN als Radikalstarter mit dem gleichen Edukt.[3][2]

Eine weitere Möglichkeit besteht aus der Nutzung von p-Chlorbenzaldehyd als Edukt. Hierbei wird das Edukt mit Dichlormethylsilan als Chlorierungsmittel und Eisentrichlorid als Katalysator in Glyme umgesetzt.[4]

Verwendung
[Bearbeiten | Quelltext bearbeiten]4-Chlorbenzylchlorid wird zur Synthese von Pflanzenschutzmitteln wie Chlorbensid[5] benötigt.[6] Es ist außerdem ein Präkursor für Pyrimethamin.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Eintrag zu alpha,4-Dichlortoluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ a b c C. Loring Jackson, Alfred W. Field: Ueber Parachlorbenzylchlorid und seine Derivate. In: Berichte der deutschen chemischen Gesellschaft. Band 11, Nr. 1, Januar 1878, S. 904–905, doi:10.1002/cber.187801101243.
- ↑ Radikalische Substitution von p-Chlortoluol zu p-Chlorbenzylchlorid
- ↑ Z. Li, C. Sheng, H. Qiu, Y. Zhang: Ferric Chloride-Catalyzed Deoxygenative Chlorination of Carbonyl Compounds to Halides. In: Organic Preparations and Procedures International: The New Journal for Organic Synthesis. Band 39, Nr. 4, 2007, S. 412–415, doi:10.1080/00304940709458597.
- ↑ Eintrag zu Chlorbenside in der Hazardous Substances Data Bank (via PubChem), abgerufen am 12. Juli 2016.
- ↑ Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, Norwich 1996, ISBN 0-8155-1853-6, S. 1029 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).

