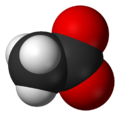
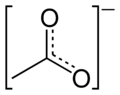
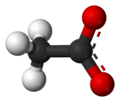
Acetat
 | |
| Općenito | |
|---|---|
| Molekularna formula | CH3CO− 2 |
| CAS registarski broj | 71-50-1 |
| SMILES | CC(=O)[O-] |
| InChI | 1/C2H4O2/c1-2(3)4/h1H3,(H,3,4)/p-1 |
| Osobine1 | |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Acetati (lat. acet – od acetus + –at[us]), soli ili estri acetatne kiseline. Sirćetna kiselina (SN3SOON) je rastvorljiva u vodi i ulazi u reakcije sa mnogim spojevima, iz kojih nastaju mnogu acetati, kao naprimjer natrij-acetat (CH3COONa), etil-acetat (CH3COOC2H5) i drugi.
U rastvoru , acetati se ponašaju drugačije od kiseline od koje potiču. Putem hidrolize, pod uticajem jačeg metalnog ona, obično poprimaju bazna svojstva. Njeni spojevi su nestabilni pa , tokom vremena, određena količina acetata mijenja oblik, uz oslobađanje kiseline, čiji se miris oseća pri otvaranju posude u kojoj nalazi. Prema strukturi, kiselina spada u monokarboksilne, a na karboksilnu grupu je vezana samo jedna metil grupa, koja značajno utiče na reaktivnost čitave molekule. Elektronegativniji kisika ima indukcijski efekt privlačenja elektrona sa susjednog ugljika karboksilne grupe. Tako se kisik obogaćuje elektronima, a osiromašuje ugljik, koji to mora nadoknaditi privlačenjem elektrona, ali znatno slabijih, sa susjedne metil grupe. Struktura acetatnog iona je također značajna za reaktivnost molekula koje ga imaju. U tom procesu, značajnu ulogu ima i kombinacija različitih tipova hibridizacije. Metil grupa je sp3 hibridizirana, a hibridizacija karboksilne grupe je sp2. Takva kombinacija omogućuje svojstvenu prostornu orijentaciju i različitost uglova veza, što pojedine atome iona štiti, a druge podstiče na reakciju.
Budući da je acetatna kiselina u kategoriji slabih kiselina, najlakše reagira sa jakim bazama kao što su NaOH i KOH, kada nastaju odgovarajuće soli (natrijev ili kalijev acetat), uz izdvajanje vode. Za tu reakciju nisu potrebni katalizatori jer se lahko odvija.[1]
- CH3–CH2COOH + NaOH → CH3-CH2COONa + H2O
Voda nastaje u reakciji H+ iona iz COOH grupe i ON- grupe iz natrij hidroksida. U ovoj reakciji se taloži natrij acetat u vidu bijela naslage na dnu epruvete.
Sirćetna kiselina u reakciji sa nekom od svojih soli koje sadrže alkalni metal stvbara vrlo stabilne pufere koji se upotrebljavaju za podešavanje određene pH vrijednosti. Acetati koji su soli jakih baza i sirćetne kiseline, u procesu hidrolize, imaju bazna svojstva. Ponekad acetati ne reagiraju bazno, već neutralno i približno tome kod SN3COONH4, gdje su oba iona slaba, sa sličnom rastvorljivosti u vodi. Acetati ne formiraju soli sirćetne kiseline samo sa neorganskim bazama. Postoje i takvi organski spojevi koji su, samo po organskoj prirodi, nazvani estrima, a nastaju reakcijom esterifikacije u kojoj učestvuju kiselina i alkohol, uz prisustvo najčešće koncentrirane sumporne kiseline. Stvaraju se estri obilježavajućih svojstava.
Struktura
[uredi | uredi izvor]-
Prostor-popunjavajući model acetatskog aniona -
Kugla-i-štap model aniona acetata -
Rezonansni hibrid acetatskog aniona -
Kanonski oblici acetatnog aniona
Biološka uloga
[uredi | uredi izvor]Acetati su veoma rašireni u biološkim strukturana i anionima. U organizmima pretežno imaju funkciju acetil kenzima A.[2] Utvrđeno je da intraperitonealna injekcija natrij acetata (20 ili 60 mg/kg tjelesne mase) izaziva glavobolju kod tretiranih pacova pa je sugerirano da je djelovanje acetate posljedica oksidacije etanola glavni faktor koji uzrokuje mahmurluka. Povećan nivo u acetata u serumu može dovesti do akumulacije adenozina u mnogim tkivima, uključujući mozak i administraciju adenozinskih receptora kofeina, što je pronađeno kod pacova nakon davanja etanola da se smanji noksno ponašanje, izazvano podraživanjem nerva, a ne oštećenjem.[3][4][5][6][7]
Fermentatacija acetata
[uredi | uredi izvor]Acetatna kiselina takođr može prolaziti kroz izmijenjene reakcije, kada proizvodi metan i ugljendioksid:[8][9]
- CH3COO− + H+ → CH4 + CO2 ΔG° = −36 kJ/mol
Ovu nesrazmjernu reakciju katalizira metanogena archaea u metabolizmu fermentacije. Jedan elektron se prenosi iz karbonil funkcije (e– donor) karboksilne grupe do metil grupe (e– akceptor) sirćetne kiseline, odnosno proizvodi CO2 i metan.[4][5]
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Zumdahl S. S. (1986). Chemistry. Lexington, Mass: D.C. Heath. ISBN 978-0-669-04529-1. CS1 održavanje: nepreporučeni parametar (link)
- ^ Nelson, D. L.; Cox, M. M. (2000): Lehninger, Principles of Biochemistry, 3rd Ed. Worth Publishing: New York, ISBN 1-57259-153-6.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 9958-10-222-6.
- ^ a b Bajrović K., Jevrić- Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo,B&H, ISBN 9958-9344-1-8.
- ^ a b Kapur Pojskić L., Ed. (2014): Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 978-9958-9344-8-3.
- ^ Maxwell, Christina; et al. "Acetate Causes Alcohol Hangover Headache in Rats". PLoS ONE. 5 (12): e15963. doi:10.1371/journal.pone.0015963. PMC 3013144. PMID 21209842. Arhivirano s originala, 3. 9. 2014. Pristupljeno 7. 4. 2016. CS1 održavanje: nepreporučeni parametar (link)
- ^ 'Is coffee the real cure for a hangover?' by Bob Holmes, New Scientist, Jan. 15 2011, p. 17.
- ^ Ferry, J.G. (1992). "Methane from acetate". Journal of Bacteriology. 174 (17): 5489–5495. Arhivirano s originala, 8. 6. 2019. Pristupljeno 7. 4. 2016.
- ^ Vogels, G. D.; Keltjens, J. T.; Van Der Drift, C. (1988). "Biochemistry of methane production". u Zehnder A. J. B. (ured.). Biology of anaerobic microorganisms. New York: Wiley. str. 707–770.