Acroleïne
| Acroleïne | ||||||
|---|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||||
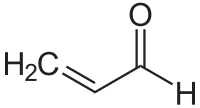
| ||||||
Structuurformule van acroleïne
| ||||||
| Algemeen | ||||||
| Molecuulformule | C3H4O | |||||
| IUPAC-naam | Prop-2-enal | |||||
| Andere namen | acrylaldehyde | |||||
| Molmassa | 56,06 g/mol | |||||
| SMILES | C(=O)C=C
| |||||
| InChI | 1/C3H4O/c1-2-3-4/h2-3H,1H2
| |||||
| CAS-nummer | 107-02-8 | |||||
| EG-nummer | 203-453-4 | |||||
| PubChem | 7847 | |||||
| Wikidata | Q342790 | |||||
| Beschrijving | Gele tot kleurloze vloeistof, met scherpe geur | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
| ||||||
| H-zinnen | H225 - H301 - H311 - H314 - H330 - H400 | |||||
| EUH-zinnen | geen | |||||
| P-zinnen | P210 - P260 - P273 - P280 - P284 - P301+P310 | |||||
| Opslag | Brandveilig opslaan, gescheiden van sterk oxiderende stoffen, sterke basen, sterke zuren, voedingswaren. Enkel gestabiliseerd opslaan. | |||||
| Fysische eigenschappen | ||||||
| Aggregatietoestand | vloeibaar | |||||
| Kleur | geel tot kleurloos | |||||
| Dichtheid | 0,8 g/cm³ | |||||
| Smeltpunt | −88 °C | |||||
| Kookpunt | 53 °C | |||||
| Vlampunt | −26 °C | |||||
| Dampdruk | 29.300 Pa | |||||
| Oplosbaarheid in water | 2 g/L | |||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
| ||||||
Acroleïne of propenal is de eenvoudigste onverzadigde aldehyde. Het is een zeer reactieve stof, die in industriële processen gebruikt wordt voor de productie van onder andere methionine (een aminozuur) of glutaaraldehyde (een biocide).
Het is een van de schadelijke stoffen in sigarettenrook[1] en de uitlaatgassen van voertuigen.
Synthese
[bewerken | brontekst bewerken]Het oudste commercieel proces voor de productie van acroleïne is ontwikkeld door Degussa in 1942 en was gebaseerd op de condensatiereactie in de gasfase van aceetaldehyde en formaldehyde.
Momenteel wordt acroleïne echter in hoofdzaak geproduceerd via de katalytische oxidatie van propeen in de gasfase. De gebruikte katalysatoren zijn complexe metaaloxiden van meestal bismut of molybdeen. Acroleïne wordt op deze manier ook gevormd in de eerste stap van de productie van acrylzuur uit propeen.
Een ander proces is de dehydratie van glycerine:
Dit is een evenwichtsreactie. Bij lage temperatuur verloopt ze naar links (de hydratie van acroleïne overheerst), terwijl bij hoge temperatuur (vanaf 200 °C) ze naar rechts (de dehydratie van glycerine overheerst) verloopt. De reactie gebeurt met een zure, vaste katalysator, zoals zouten van fosforzuur, geïmpregneerd op diatomeeënaarde.[2] Een nadeel is de vorming van nevenproducten in een aantal nevenreacties. Die moeten nadien uit het reactiemengsel verwijderd worden en ze kunnen voor roetafzettingen op de katalysator zorgen. Indien de reactie in aanwezigheid van zuurstof gebeurt zou de vorming van nevenproducten verminderd en de levensduur van de katalysator verlengd worden.[3]
Acroleïne is ook een bijproduct van de productie van acrylonitril.
Biologische rol
[bewerken | brontekst bewerken]Acroleïne werd ontdekt in de wijnindustrie. Tijdens de gisting van wijn worden kleine hoeveelheden glycerol gemaakt die de wijn een volle, ronde smaak geven. Verder komen in wijn ook melkzuurbacteriën voor die appelzuur omzetten in melkzuur, waardoor de wijn een minder zure smaak krijgt. Sommige van deze melkzuurbacteriën kunnen glycerol omzetten in 3-hydroxypropionaldehyde (3-HPA). In een zuur milieu (wijn) of bij hoge temperatuur wordt 3-HPA gedehydrolyseerd en ontstaat acroleïne. De aanwezigheid van acroleïne is ongewild omdat het zorgt voor een bittere smaak in de wijn.[4]
Toepassingen
[bewerken | brontekst bewerken]In de Europese Unie wordt acroleïne uitsluitend gebruikt als tussenproduct voor de productie van andere stoffen zoals methionine, acrylzuur of glutaaraldehyde. Buiten de EU wordt het ook gebruikt als een niet-specifiek biocide.
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Acroleïne is een licht ontvlambare stof. In lucht kan de damp een ontplofbaar mengsel vormen (explosiegrenzen tussen 2,8 en 31 volumeprocent in lucht). De damp is zwaarder dan lucht en kan zich langs de grond verspreiden en op afstand ontstoken worden. Acroleïne kan spontaan polymeriseren, waardoor risico op brand of ontploffing ontstaan. De stof reageert in aanwezigheid van sterke zuren, sterke basen of sterk oxiderende stoffen. Deze reacties kunnen ook tot brand of ontploffing leiden. Acroleïne kan ook ontplofbare peroxiden vormen. Bij opslag of transport ervan moet daarom steeds een stabilisator worden toegevoegd (hydrochinon).
Acroleïne kan in het lichaam opgenomen worden door inademing van de damp, langs de huid of door inslikken. Blootstelling aan de huid of de ogen veroorzaakt sterke irritatie en tranende ogen. Bij inademing van een hoge dosis kan longoedeem, vaak pas na enkele uren, optreden.
Acroleïne is ook milieugevaarlijk en zeer giftig voor in water levende organismen.
Externe links
[bewerken | brontekst bewerken] acroleïne - International Chemical Safety Card
acroleïne - International Chemical Safety Card- European Chemical Substances Information System
- (en) Gegevens van acroleïne in de GESTIS-stoffendatabank van het IFA
- European Union Risk Assessment Report, Acrolein-, Volume 7 (2001). ISBN 92-894-0501-5. (Beschikbaar op de website van het European Chemical Substances Information System)
- ↑ 9 schadelijke stoffen in tabaksrook (WHO). RIVM. Gearchiveerd op 8 december 2023. Geraadpleegd op 5 maart 2024.
- ↑ Zie bv. U.S. Patent 2558520, Production of acrolein from glycerol, van 26 juni 1951 voor U.S. Industrial Chemicals. Gearchiveerd op 6 december 2021.
- ↑ Zie US Patent 7396962, Process for dehydrating glycerol to acrolein, van 8 juli 2008 voor Arkema France
- ↑ A. Lonvaud-Funel, (2002) Lactic acid bacteria in winemaking: Influence on sensorial and hygienic quality. Progress in Industrial Microbiology 36: 231-262





