Argon
| Argon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Argon solide et liquide. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Position dans le tableau périodique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Ar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom | Argon | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro atomique | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Période | 3e période | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloc | Bloc p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Famille d'éléments | Gaz noble | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Ne] 3s2 3p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques de l'élément | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 39,948 ± 0,001 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | (71 pm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 106 ± 10 pm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | 188 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État d’oxydation | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | inconnu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 15,759 610 eV | 2e : 27,629 66 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e : 40,74 eV | 4e : 59,81 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5e : 75,02 eV | 6e : 91,009 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7e : 124,323 eV | 8e : 143,460 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9e : 422,45 eV | 10e : 478,69 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11e : 538,96 eV | 12e : 618,26 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13e : 686,10 eV | 14e : 755,74 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15e : 854,77 eV | 16e : 918,03 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17e : 4 120,885 7 eV | 18e : 4 426,229 6 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques du corps simple | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | Gaz (non magnétique) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
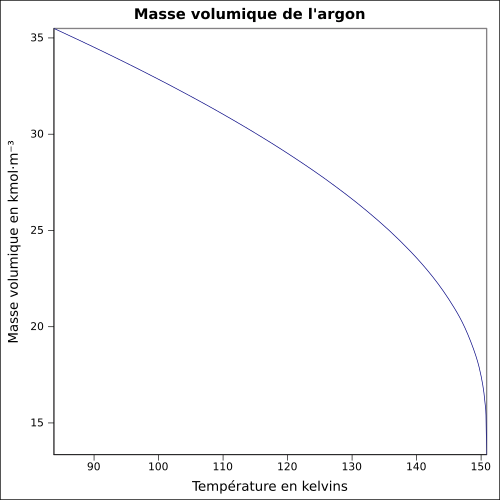
| Masse volumique | 1,783 7 g·L-1 (0 °C, 1 atm)[3] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Système cristallin | Cubique à faces centrées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | incolore | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | −189,36 °C[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | −185,85 °C[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 1,188 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 6,43 kJ·mol-1 (1 atm, −185,85 °C)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Température critique | −122,3 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point triple | −189,344 2 °C, 688,9 hPa[5],[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 22,414×10-3 m3·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 319 m·s-1 à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 520 J·kg-1·K-1
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 0,017 72 W·m-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | [7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.028.315 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 231-147-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No E | E938 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H280 et P403 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT[9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 A, |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'argon est l'élément chimique de numéro atomique 18 et de symbole Ar. Il appartient au groupe 18 du tableau périodique et fait partie de la famille des gaz nobles, également appelés « gaz rares », qui regroupe également l'hélium, le néon, le krypton, le xénon et le radon. L'argon est le troisième constituant le plus abondant de l'atmosphère terrestre, avec une fraction massique de 1,288 %, correspondant à une fraction volumique de 0,934 % (soit 9 340 ppm), et est le gaz noble le plus abondant de l'écorce terrestre, dont il représente 1,5 ppm. L'argon de l'atmosphère terrestre est presque entièrement constitué d'argon 40, nucléide radiogénique provenant de la désintégration du potassium 40, tandis que l'argon observé dans l'univers est essentiellement constitué d'argon 36, produit par nucléosynthèse stellaire dans les supernovae.
Le nom argon provient du grec ancien ἀργός / argós, « oisif, paresseux » (contraction de ἄεργος / áergos, de même sens), en référence au fait que cet élément est chimiquement inerte. Sa configuration électronique présente une couche de valence saturée à l'origine de sa stabilité et de la quasi impossibilité d'établir des liaisons covalentes. La température de son point triple, 83,805 8 K, est l'un des points de référence de l'Échelle internationale de température de 1990 (ITS-90).
L'argon est produit industriellement par distillation fractionnée d'air liquéfié. Il est utilisé essentiellement comme atmosphère inerte pour le soudage et divers procédés industriels à haute température faisant intervenir des substances réactives. On utilise ainsi une atmosphère d'argon dans les fours à arc électrique au graphite pour éviter la combustion de ce dernier. On emploie également l'argon dans l'éclairage par lampes à incandescence, tubes fluorescents et tubes à gaz. Il permet de réaliser des lasers à gaz bleu-vert.
Propriétés principales
[modifier | modifier le code]
L'argon est incolore, inodore, ininflammable et non toxique aussi bien à l'état gazeux que liquide ou solide. Sa solubilité dans l'eau est à peu près comparable à celle de l'oxygène et vaut 2,5 fois celle de l'azote. Il est chimiquement inerte dans à peu près toutes les conditions et ne forme aucun composé chimique confirmé à température ambiante.
L'argon est cependant susceptible de former des composés chimiques dans certaines conditions extrêmes hors équilibre. Le fluorohydrure d'argon HArF a ainsi été obtenu par photolyse ultraviolette de fluorure d'hydrogène HF dans une matrice cryogénique d'iodure de césium CsI et d'argon Ar[10] ; stable en dessous de 27 K (−246,15 °C), il a été identifié par spectroscopie infrarouge[11]. Le fluorohydrure d'argon est le seul composé connu de l'argon qui soit neutre et stable à l'état fondamental.
L'argon peut également former des clathrates dans l'eau lorsque ses atomes sont emprisonnés dans le réseau tridimensionnel formé par la glace[12]. Il existe par ailleurs des ions polyatomiques contenant de l'argon, comme le cation hydrure d'argon ArH+, et des exciplexes, tels qu'Ar2* et ArF*. Divers composés présentant des liaisons Ar–C et Ar–Si stables ont été prédits par simulation numérique mais n'ont pas été synthétisés en laboratoire[13].
Isotopes
[modifier | modifier le code]Les principaux isotopes d'argon présents dans l'écorce terrestre sont l'argon 40 (40Ar) pour 99,6 %, l'argon 36 (36Ar) pour 0,34 % et l'argon 38 (38Ar) pour 0,06 %. Le potassium 40 (40K) se désintègre spontanément à raison de 11,2 % en argon 40 par capture électronique ou émission de positron et à raison de 88,8 % en calcium 40 (40Ca) par désintégration β− avec une période radioactive (demi-vie) de 1,25 milliard d'années. Cette durée et le rapport entre les sous-produits formés permettent de déterminer l'âge de roches par la méthode de la datation au potassium-argon[14].
Dans l'atmosphère terrestre, l'argon 39 est produit essentiellement par l'interaction du rayonnement cosmique sur l'argon 40 par capture neutronique suivie par une double émission de neutron[15]. Dans le sous-sol, il peut être également produit à partir de potassium 39 par capture neutronique suivie par une émission de proton.
L'argon 37 est produit lors d'essais nucléaires souterrains à partir de calcium 40 par capture neutronique suivie d'une désintégration α ; il présente une période radioactive de 35 jours[16].
L'argon est remarquable par le fait que sa composition isotopique varie sensiblement d'une région du Système solaire à l'autre. L'argon dont la source principale est la désintégration radioactive du potassium 40 des roches est constitué majoritairement d'argon 40, comme sur les planètes telluriques retenant une atmosphère : Vénus, la Terre et Mars. En revanche, l'argon formé directement par nucléosynthèse stellaire est essentiellement constitué d'argon 36 produit par réaction alpha, ce qui est le cas du Soleil, dont l'argon est à 84,6 % de l'argon 36 selon les mesures du vent solaire[17]. Il en est de même dans les planètes géantes, où l'abondance relative des isotopes 36Ar : 38Ar : 40Ar vaut 8400 : 1600 : 1[18].
Outre l'atmosphère terrestre, qui présente une fraction volumique de 0,934 % d'argon, soit 9 340 ppm, l'atmosphère de Mercure en contient 0,07 ppm, celle de Vénus en contient 70 ppm, et celle de Mars en contient 19 300 ppm, soit 1,93 %[19].
La prédominance de l'argon 40 radiogénique dans l'atmosphère terrestre est responsable du fait que la masse atomique de l'argon terrestre, de l'ordre de 39,95 u, est supérieure de 0,85 u à celle du potassium, qui le suit dans le tableau périodique des éléments et dont la masse atomique est de l'ordre de 39,10 u. Ceci semblait paradoxal lors de la découverte de l'argon en 1894[20] car Dmitri Mendeleïev avait rangé son tableau périodique par ordre de masse atomique croissante, ce qui conduisait à devoir placer l'argon entre le potassium et le calcium, de masse atomique voisine de 40,08 u et confondue avec celle de l'argon à 0,13 u près, alors qu'il y avait une différence de masse atomique de 3,65 u entre le chlore (35,45 u) et le potassium (39,10 u). Ce problème fut résolu par Henry Moseley, qui démontra en 1913 que le tableau périodique devait être rangé par ordre de numéro atomique croissant, et non par masse atomique croissante, ce qui classait les éléments dans le bon ordre.
L'abondance atmosphérique relative de l'argon par rapport aux autres gaz nobles — 9 340 ppm d'argon, contre 5,24 ppm d'hélium, 18,18 ppm de néon, 1,14 ppm de krypton et 0,087 ppm de xénon — peut aussi être attribuée à l'argon 40 radiogénique : l'argon 36 présente en effet une abondance de seulement 31,5 ppm (0,337 % de 9 340 ppm), du même ordre de grandeur que celle du néon (18,18 ppm).
Composés
[modifier | modifier le code]L'atome d'argon présente une couche de valence saturée d'électrons, avec des sous-couches s et p complètes. Ceci rend cet élément chimiquement inerte et très stable, c'est-à-dire qu'il ne forme de liaison chimique avec d'autres atomes que très difficilement. Jusqu'en 1962, les gaz nobles étaient considérés comme totalement inertes et impropres à la formation de composés chimiques ; à cette date cependant, la synthèse de l'hexafluoroplatinate de xénon[21] XePtF6 ouvrit la voie à la chimie des gaz nobles.
Le premier composé d'argon avec le pentacarbonyle de tungstène, de formule chimique W(CO)5Ar, fut publié en 1975, mais son existence réelle demeura contestée[22]. En août 1962 fut synthétisé à l'Université d'Helsinki le fluorohydrure d'argon HArF par photolyse ultraviolette de fluorure d'hydrogène HF dans une matrice cryogénique d'iodure de césium CsI et d'argon Ar, composé stable en dessous de 27 K (−246,15 °C) identifié par spectroscopie infrarouge[11]. Cette découverte fit accepter l'idée que l'argon puisse former des composés faiblement liés[23].
Le dication métastable ArCF22+, isoélectronique avec le fluorure de carbonyle COF2 et le phosgène COCl2 du point de vue des électrons de valence, a été observé en 2009[24], mettant en œuvre une liaison carbone–argon. L'ion moléculaire 36ArH+, correspondant au cation hydrure d'argon 36 (argonium), a été détecté dans le milieu interstellaire au niveau de la nébuleuse du Crabe[25] ; c'est le premier composé de gaz noble détecté dans l'espace.
L'hydrure d'argon solide Ar(H2)2 est un composé de van der Waals présentant la même structure cristalline que la phase de Laves (en) MgZn2. Il se forme à des pressions comprises entre 4,3 et 220 GPa, bien que des résultats obtenus par spectroscopie Raman suggèrent que les molécules H2 du composé Ar(H2)2 se dissocient au-dessus de 175 GPa[26].
Production industrielle et applications
[modifier | modifier le code]L'argon est produit industriellement par distillation fractionnée d'air liquéfié dans des unités cryogéniques de distillation de l'air (en), procédé qui permet de séparer l'azote liquide, qui bout à 77,3 K, de l'argon, qui bout à 87,3 K, et de l'oxygène liquide, qui bout à 90,2 K. La production mondiale d'argon est de l'ordre de 700 000 tonnes par an[14],[27].
L'argon présente plusieurs propriétés intéressantes qui justifient son utilisation industrielle :
- c'est un gaz chimiquement inerte ;
- c'est une alternative bon marché lorsque l'azote n'est pas suffisamment inerte ;
- il a une faible conductivité thermique (c'est donc un isolant thermique) ;
- ses propriétés électroniques (ionisation, spectre d'émission) sont mises à profit dans certaines applications d'éclairage.
D'autres gaz nobles présentent des propriétés semblables et pourraient être également utilisés, mais l'argon est de loin le moins cher de tous, étant obtenu comme sous-produit de l'extraction de l'oxygène et de l'azote de l'air par distillation fractionnée cryogénique.
Applications industrielles
[modifier | modifier le code]L'argon est utilisé dans certains procédés industriels à haute température au cours desquels des substances chimiquement inertes tendent à devenir réactives. Une atmosphère d'argon est ainsi utilisée dans les fours électriques à électrodes de graphite afin de prévenir la combustion de ce matériau.
Pour certains de ces procédés, la présence d'azote ou d'oxygène provoquerait des défauts dans le matériau. L'argon est utilisé dans certains types de soudage à l'arc comme le soudage MIG-MAG et le soudage TIG, ainsi que dans le traitement du titane et d'autres éléments réactifs. On fait également croître les cristaux de silicium et de germanium destinés à l'industrie des semi-conducteurs sous atmosphère d'argon pour en assurer la qualité cristalline.
L'argon est utilisé dans l'industrie avicole comme méthode d'abattage par atmosphère contrôlée pour asphyxier les volailles, que ce soit pour un abattage de masse après l'apparition d'une maladie ou comme moyen d'abattage alternatif à l'électronarcose. La densité relative de l'argon par rapport à l'air le fait rester près du sol lors du gazage[28]. Sa nature non réactive le rend compatible avec les produits alimentaires[29], et le fait qu'il se substitue partiellement à l'oxygène dans les tissus allonge la durée de conservation alimentaire[30].
L'argon est parfois utilisé pour éteindre des incendies en préservant les équipements de valeur, comme des serveurs informatiques, qui seraient endommagés par l'utilisation d'eau ou de mousses[31].

Applications médicales
[modifier | modifier le code]Des procédures de cryochirurgie (en) telles que la cryoablation utilisent l'argon liquide pour détruire des tissus comme des cellules cancéreuses. On a pu l'employer dans une procédure dite argon-enhanced coagulation, qui est une forme d'électrochirurgie (en) par torche à plasma, mais qui présente un risque d'embolie gazeuse matérialisé par la mort d'au moins un patient[32].
Des lasers bleus à argon sont utilisés en chirurgie pour la suture des artères, détruire des tumeurs, en chirurgie oculaire[14], ou encore pour l'électrocoagulation par voie endoscopique de lésions responsables de saignements digestifs[33].
L'argon a également été expérimenté pour remplacer l'azote dans le gaz respiratoire appelé Argox (en) afin d'accélérer l'élimination de l'azote dissous dans le sang[34].
Recherche scientifique
[modifier | modifier le code]L'argon liquide est utilisé comme cible pour la détection des neutrinos et les recherches sur la matière noire. Les interactions entre les hypothétiques WIMPs et les noyaux des atomes d'argon devrait produire une scintillation observable à travers des tubes photomultiplicateurs. Les détecteurs à deux phases contenant de l'argon gazeux sont utilisés pour détecter les électrons produits par ionisation lors des interactions WIMP-noyaux d'argon.
Comme les autres gaz nobles liquéfiés, l'argon liquide a un taux de scintillation élevé (environ 51 photons/keV[35]), est transparent pour sa propre scintillation, et est relativement facile à purifier. Il est moins cher que le xénon et présente un profil temporel de scintillation différent, ce qui permet de distinguer les interactions électroniques des interactions nucléaires. Il présente en revanche une plus forte radioactivité β en raison de sa contamination par l'argon 39, sauf à utiliser de l'argon issu du sous-sol terrestre, appauvri en 39Ar, dont la période radioactive n'est que de 269 ans et dont le stock n'est pas reconstitué par l'interaction 40Ar(n,2n)39Ar du rayonnement cosmique sur l'argon atmosphérique[36].
Dans un autre registre, l'argon 39 a été employé notamment pour dater des eaux souterraines et des carottes de glace en Antarctique[15]. La datation par le potassium-argon et la datation argon-argon sont également employées pour la datation radiométrique de roches sédimentaires, métamorphiques et ignées[14].
Conservateur
[modifier | modifier le code]L'argon, numéro E938, est utilisé comme conservateur alimentaire afin d'éliminer l'oxygène et l'humidité de l'atmosphère contenue dans les emballages et retarder leur date limite de consommation. L'oxydation par l'air, l'hydrolyse et les autres réactions qui dégradent les produits sont ainsi retardées ou entièrement bloquées. Les réactifs chimiques et les molécules pharmaceutiques sont parfois emballés sous atmosphère d'argon. Ce gaz noble est également utilisé comme conservateur pour les vernis, le polyuréthane ou encore les peintures.
L'argon est également utilisé en vinification pour protéger le vin de l'oxygène et prévenir son oxydation ainsi que les interactions bactériennes indésirables (notamment les bactéries acétiques, qui produisent de l'acide acétique et font tourner le vin en vinaigre). Il peut également être utilisé comme gaz propulseur pour sprays.
Équipements de laboratoire
[modifier | modifier le code]
L'argon peut être utilisé comme gaz inerte pour rampe à vide et boîte à gants ; il est préféré à l'azote, moins cher, car l'azote est susceptible de réagir avec des composés particulièrement réactifs, ainsi qu'avec certains équipements. De plus, l'argon présente l'avantage d'être plus dense que l'air, contrairement à l'azote, ce qui le rend plus simple à utiliser en pratique.
L'argon peut être utilisé comme gaz porteur en chromatographie en phase gazeuse et en ionisation par électronébuliseur. C'est le gaz de prédilection pour le plasma utilisé en spectrométrie à plasma à couplage inductif. L'argon est utilisé préférentiellement en dépôt par pulvérisation cathodique (en) sur les spécimens à étudier par microscopie électronique à balayage et pour le nettoyage des wafers en microfabrication.
Éclairage
[modifier | modifier le code]Une lampe à incandescence est généralement remplie d'argon afin de préserver son filament de l'oxydation à haute température. L'argon est également utilisé pour son rayonnement par ionisation, comme dans les lampes à plasma et les calorimètres en physique des particules. Les lampes à décharge remplies d'argon pur produisent une lumière violet pâle tirant sur le bleu lavande, qui devient bleue en ajoutant un peu de mercure.
L'argon est également utilisé pour les lasers ioniques (en) bleus et verts.

Applications diverses
[modifier | modifier le code]L'argon est utilisé comme isolant thermique pour double vitrage. On l'utilise également pour le remplissage des combinaisons étanches pour plongée en scaphandre autonome en raison de son inertie chimique et de sa faible conductivité thermique.
L'argon est l'un des gaz pouvant être utilisé en astronautique comme propulseur des VASIMR. Dans le domaine de l'armement aérien, il est utilisé sous pression pour refroidir, en se détendant, la tête de certains missiles air-air, dont des missiles AIM-9 Sidewinder.
L'argon a été utilisé en athlétisme comme dopant simulant l'hypoxie. Il a de ce fait été inclus, avec le xénon, à la liste des méthodes et des substances interdites par l'Agence mondiale antidopage en 2014 avant d'en être retiré en 2020.
Histoire et étymologie
[modifier | modifier le code]Le mot argon dérive du grec ancien ἀργός / argós, « oisif, paresseux, stérile », formé du préfixe grec privatif ἀ- / a- et du mot ἔργον / érgon, « travail », cette étymologie évoquant le caractère inerte de l'élément[37].
La présence dans l’air d'un gaz chimiquement inerte fut suspectée par Henry Cavendish dès 1785[38] mais sa découverte par Lord Rayleigh et Sir William Ramsay à l'University College de Londres attendit 1894. Ils procédèrent en éliminant d'un échantillon d'air pur son oxygène, son dioxyde de carbone, sa vapeur d'eau et son azote, ce qui laissait un gaz inerte qu'ils appelèrent argon[39],[40],[41]. Ces deux scientifiques firent à la Royal Society la communication officielle de leur découverte le [42].
Ils furent mis sur la piste par le fait que l’azote produit chimiquement était 0,5 % plus léger que celui extrait de l’air par élimination des autres gaz atmosphériques connus à l'époque. La distillation fractionnée d’air liquéfié leur permit de produire une quantité notable d’argon en 1898 et par la même occasion d’isoler deux autres gaz nobles le néon et le xénon.
L’argon fut également observé en 1882 au cours de travaux indépendants par H. F. Newall et W. N. Hartley, qui notèrent des raies spectrales dans le spectre d'émission de l'air ne correspondant à aucun élément chimique connu[43].
Le symbole chimique de l’argon fut A jusqu'en 1957, date à laquelle il devint Ar[44].
Dangers
[modifier | modifier le code]Tout comme l’hélium, l’argon n’est pas dangereux à faible concentration. Toutefois, il est 38 % plus dense que l'air et l'inhalation d’une grande quantité d'argon comporte des risques d’asphyxie par privation d’oxygène (anoxie) ; ceci peut se produire par exemple lors d'opérations de soudage dans un espace confiné.
Notes et références
[modifier | modifier le code]- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, , 87e éd. (ISBN 0849304873), p. 10-202
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, pp. T1-T21 (et pp. T23-T42, version anglaise).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 92e éd. (ISBN 1-4398-5511-0)
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Entrée du numéro CAS « 7440-37-1 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 janvier 2009 (JavaScript nécessaire)
- « Argon » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Markku Räsänen, « Argon out of thin air », Nature Chemistry, vol. 6, no 1, , article no 82 (PMID 24345939, DOI 10.1038/nchem.1825, lire en ligne)
- (en) Leonid Khriachtchev, Mika Pettersson, Nino Runeberg, Jan Lundell et Markku Räsänen, « A stable argon compound », Nature, vol. 406, no 6798, , p. 874-876 (PMID 10972285, DOI 10.1038/35022551, Bibcode 2000Natur.406..874K, lire en ligne)
- (en) V. R. Belosludov, O. S. Subbotin, D. S. Krupskii, O. V. Prokuda, R. V. Belosludov et Y. Kawazoe, « Microscopic model of clathrate compounds », Journal of Physics: Conference Series, vol. 29, no 1, , p. 1-7 (DOI 10.1088/1742-6596/29/1/001, Bibcode 2006JPhCS..29....1B, lire en ligne)
- (en) Arik Cohen, Jan Lundell et R. Benny Gerber, « First compounds with argon–carbon and argon–silicon chemical bonds », Journal of Chemical Physics, vol. 119, no 13, , p. 6415-6417 (DOI 10.1063/1.1613631, Bibcode 2003JChPh.119.6415C, lire en ligne)
- (en) J. Emsley, Nature's Building Blocks, Oxford University Press, 2001, p. 44–45. (ISBN 978-0-19-960563-7)
- Étienne Roth (dir.), Bernard Poty (dir.), Robert Delmas et al. (préf. Jean Coulomb), Méthodes de datation par les phénomènes nucléaires naturels, Paris, Éditions Masson, coll. « Collection CEA », , 631 p. (ISBN 978-2-225-80674-2, BNF 34836710), chap. 17 (« Silicium 32 et argon 39 »)
- (en) The Science Case for 37Ar as a Monitor for Underground Nuclear Explosions, page 1, 2010
- (en) Katharina Lodders, « The Solar Argon Abundance », The Astrophysical Journal, vol. 674, no 1, , p. 607-611 (DOI 10.1086/524725, Bibcode 2008ApJ...674..607L, arXiv arXiv:0710.4523, lire en ligne)
- (en) A. G. W. Cameron, « Elemental and isotopic abundances of the volatile elements in the outer planets », Space Science Reviews, vol. 14, nos 3-4, , p. 392-400 (DOI 10.1007/BF00214750, Bibcode 1973SSRv...14..392C, lire en ligne)
- (en) Paul R. Mahaffy, Christopher R. Webster, Sushil K. Atreya, Heather Franz, Michael Wong, Pamela G. Conrad, Dan Harpold, John J. Jones, Laurie A. Leshin, Heidi Manning, Tobias Owen, Robert O. Pepin, Steven Squyres, Melissa Trainer, MSL Science Team, « Abundance and Isotopic Composition of Gases in the Martian Atmosphere from the Curiosity Rover », Science, vol. 341, no 6143, , p. 263-266 (PMID 23869014, DOI 10.1126/science.1237966, Bibcode 2013Sci...341..263M, lire en ligne)
- (en) Marco Fontani, Mariagrazia Costa et Mary Virginia Orna, The Lost Elements : The Periodic Table's Shadow Side, New York, Oxford University Press, (1re éd. 2014), 531 p. (ISBN 9780199383344), p. 182.
- (en) Neil Bartlett, « Xenon hexafluoroplatinate Xe+[PtF6]− », Proceedings of the Chemical Society, no 6, , p. 197-236 (DOI 10.1039/PS9620000197, lire en ligne)
- (en) Nigel A. Young, « Main group coordination chemistry at low temperatures: A review of matrix isolated Group 12 to Group 18 complexes », Coordination Chemistry Reviews, vol. 257, nos 5-6, , p. 956-1010 (DOI 10.1016/j.ccr.2012.10.013, lire en ligne)
- (en) Neil Bartlett, « The Noble Gases », Chemical & Engineering News, vol. 81, no 36, , p. 32-34 (DOI 10.1021/cen-v081n036.p032, lire en ligne)
- (en) Jessica F. Lockyear, Kevin Douglas, Stephen D. Price, Małgorzata Karwowska, Karol J. Fijalkowski, Wojciech Grochala, Marek Remeš, Jana Roithová et Detlef Schröder, « Generation of the ArCF22+ Dication », The Journal of Physical Chemistry Letters, vol. 1, no 1, , p. 358-362 (DOI 10.1021/jz900274p, lire en ligne)
- (en) M. J. Barlow, B. M. Swinyard, P. J. Owen, J. Cernicharo, H. L. Gomez, R. J. Ivison, O. Krause, T. L. Lim, M. Matsuura, S. Miller, G. Olofsson et E. T. Polehampton, « Detection of a Noble Gas Molecular Ion, 36ArH+, in the Crab Nebula », Science, vol. 342, no 6164, , p. 1343-1345 (PMID 24337290, DOI 10.1126/science.1243582, Bibcode 2013Sci...342.1343B, lire en ligne)
- (en) Annette K. Kleppe, Mónica Amboage et Andrew P. Jephcoat, « New high-pressure van der Waals compound Kr(H2)4 discovered in the krypton-hydrogen binary system », Scientific Reports, vol. 4, , article no 4989 (DOI 10.1038/srep04989, Bibcode 2014NatSR...4E4989K, lire en ligne)
- « Periodic Table of Elements: Argon – Ar », Environmentalchemistry.com (consulté le ).
- (en) Sara J. Shields et A. B. M. Raj, « A Critical Review of Electrical Water-Bath Stun Systems for Poultry Slaughter and Recent Developments in Alternative Technologies », Journal of Applied Animal Welfare Science, vol. 13, no 4, , p. 281-299 (PMID 20865613, DOI 10.1080/10888705.2010.507119, lire en ligne)
- D. L. Fletcher, « Slaughter Technology », Symposium: Recent Advances in Poultry Slaughter Technology, (lire en ligne, consulté le )
- (en) M. J. Fraqueza et A. S. Barreto, « The effect on turkey meat shelf life of modified-atmosphere packaging with an argon mixture », Poultry Science, vol. 88, no 9, , p. 1991-1998 (PMID 19687286, DOI 10.3382/ps.2008-00239, lire en ligne)
- (en) Joseph Z. Su, Andrew K. Kim, George P. Crampton et Zhigang Liu, « Fire Suppression with Inert Gas Agents », Journal of Fire Protection Engineering, vol. 11, no 2, , p. 72-87 (DOI 10.1106/X21V-YQKU-PMKP-XGTP, lire en ligne)
- (en) « Fatal Gas Embolism Caused by Overpressurization during Laparoscopic Use of Argon Enhanced Coagulation », Health Devices, vol. 23, no 6, , p. 257-259 (lire en ligne)
- (en) Jerome Canady, Kimberly Wiley et Biagio Ravo, « Argon plasma coagulation and the future applications for dual-mode endoscopic probes », Reviews in Gastroenterological Disorders, vol. 6, no 1, , p. 1-12 (ISSN 1533-001X, PMID 16520707, lire en ligne, consulté le ).
- (en) Andrew A Pilmanis, Ulf I. Balldin, James T. Webb et Kevin M. Krause, « Staged Decompression to 3.5 Psi Using Argon-Oxygen and 100% Oxygen Breathing Mixtures », Aviation, Space, and Environmental Medicine, vol. 74, no 12, , p. 1243-1250 (PMID 14692466, lire en ligne)
- (en) Dan Gastler, Ed Kearns, Andrew Hime, Laura C. Stonehill, Stan Seibert, Josh Klein, W. Hugh Lippincott, Daniel N. McKinsey et James A. Nikkel, « Measurement of scintillation efficiency for nuclear recoils in liquid argon », Physical Review C, vol. 85, no 6, , article no 065811 (DOI 10.1103/PhysRevC.85.065811, Bibcode 2012PhRvC..85f5811G, arXiv 1004.0373, lire en ligne)
- (en) J.Xu, F. Calaprice, C. Galbiati, A. Goretti, G. Guray, T. Hohman, D. Holtz, An. Ianni, M. Laubenstein, B. Loer, C. Lovec, C. J. Martoff, D. Montanari, S. Mukhopadhyay, A. Nelson, S. D. Rountree, R. B. Vogelaar et A. Wright, « A study of the trace 39Ar content in argon from deep underground sources », Astroparticle Physics, vol. 66, , p. 53-60 (DOI 10.1016/j.astropartphys.2015.01.002, Bibcode 2015APh....66...53X, arXiv 1204.6011, lire en ligne)
- Paul Depovere, La classification périodique des éléments. La merveille fondamentale de l'Univers, De Boeck Supérieur, , p. 98.
- (en) Henry Cavendish, « XXIII. Experiments on air. », Philosophical Transactions of the Royal Society of London, vol. 75, , p. 372-384 (DOI 10.1098/rstl.1785.0023, Bibcode 1785RSPT...75..372C, lire en ligne)
- (en) Robert John Strutt et William Ramsay, « I. Argon, a new constituent of the atmosphere », Proceedings of the Royal Society of London, vol. 57, , p. 265-287 (DOI 10.1098/rspl.1894.0149, JSTOR 115394, lire en ligne)
- (en) John William Strutt et William Ramsay, « VI. Argon, a new constituent of the atmosphere », Philosophical Transactions of the Royal Society of London, , p. 187-241 (DOI 10.1098/rsta.1895.0006, JSTOR 90645, Bibcode 1895RSPTA.186..187R, lire en ligne)
- (en) Sir William Ramsay, « The Rare Gases of the Atmosphere », sur nobelprize.org, Prix Nobel de Chimie, (consulté le ).
- (en) John H. Holloway, Noble-gas chemistry, Methuen, , p. 6
- (en) John Emsley, Nature's Building Blocks: An A-Z Guide to the Elements, Oxford University Press, 2003, p. 36. (ISBN 0198503407)
- (en) Norman E. Holden, « History of the Origin of the Chemical Elements and Their Discoverers », 41st IUPAC General assembly in Brisbane, Australia June 29th - July 8th, 2001, sur nndc.bnl.gov, National Nuclear Data Center, (consulté le ).
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- (en) « Technical data for Argon » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- (en) Images de l'argon sous différentes formes
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |