Bromoacétate d'éthyle
| Bromoacétate d'éthyle | |
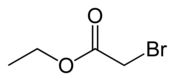
| |
| Structure du bromoacétate d'éthyle | |
| Identification | |
|---|---|
| Nom UICPA | 2-bromoacétate d'éthyle |
| No CAS | |
| No ECHA | 100.002.992 |
| No CE | 203-290-9 |
| No RTECS | AF6000000 |
| PubChem | 7748 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C4H7BrO2 |
| Masse molaire[1] | 167,001 ± 0,005 g/mol C 28,77 %, H 4,22 %, Br 47,85 %, O 19,16 %, |
| Propriétés physiques | |
| T° fusion | −38 °C[2] |
| T° ébullition | 168,5 °C[2] |
| Solubilité | se décompose au contact de l'eau |
| Masse volumique | 1,5 g·cm-3[2] à 20 °C |
| Point d’éclair | 48 °C[2] |
| Pression de vapeur saturante | 450 Pa[2] à 20 °C |
| Précautions | |
| SGH[2] | |
| H226, H300+H310+H330, P260, P264, P280, P284, P301+P310 et P302+P350 |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le bromoacétate d'éthyle est un composé chimique de formule BrCH2COOCH2CH3. C'est l'ester éthylique de l'acide bromoacétique BrCH2COOH. On l'obtient en deux étapes à partir de l'acide acétique CH3COOH[3]. C'est un gaz lacrymogène à l'odeur fruitée et piquante[4] qui se présente comme un liquide incolore lorsqu'il est pur, mais est généralement teinté de jaune en raison d'impuretés. C'est également un agent alkylant très toxique qui peut être fatal s'il est inhalé.
Il aurait été utilisé pour la première fois par la police française en 1912 pour disperser des voleurs de banque[5] et est recensé par l'organisation mondiale de la santé comme instrument de maintien de l'ordre[6]. Il a été utilisé au cours de la Première Guerre mondiale comme gaz de combat et, au cours de la Seconde Guerre mondiale, comme signature olfactive identifiant les cristaux de Zyklon B, peu odorants par ailleurs, afin d'avertir du danger du cyanure d'hydrogène HCN qui s'en échappe.
En synthèse organique, c'est un agent alkylant polyvalent. Son utilisation principale est dans la réaction de Réformatski, au cours de laquelle il réagit avec du zinc pour former un énolate de zinc BrZnCH2COOCH2CH3 ; ce dernier se condense avec des composés carbonylés pour former des esters β-hydroxy.
C'est également le point de départ pour la préparation de plusieurs autres réactifs. Par exemple, le réactif de Wittig associé, préparé par réaction avec la triphénylphosphine P(C6H5)3, est couramment utilisé pour préparer des esters α,β-insaturés à partir de composés à carbonyle tels que le benzaldéhyde :

Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Ethyl bromoacetate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 avril 2018 (JavaScript nécessaire)
- (en) Samuel Natelson, Sidney Gottfried, Nathan L. Drake et Stuart Haywood, « Ethyl Bromoacetate », Organic Syntheses, vol. 23, , p. 37 (DOI 10.15227/orgsyn.023.0037, lire en ligne)
- (en) D. W. Criswell, F. L. McClure, R. Schaefer et K. R. Brower, « War gases as olfactory probes », Science, vol. 210, no 4468, , p. 425-426 (PMID 6968976, DOI 10.1126/science.6968976, lire en ligne)
- (en) Charles E. Heller, « Chemical Warfare in World War I: The American Experience, 1917 - 1918 », sur https://web.archive.org/ (original à l'adresse http://www-cgsc.army.mil/carl/resources/csi/Heller/HELLER.asp), (consulté le ).
- (en) « 3. Biological and Chemical Agents », sur http://www.who.int/ (consulté le ).




