Bulbokapnina
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C19H19NO4 | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
325,36 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Podobne związki |
pozostałe dwa główne alkaloidy izochinolinowe kokoryczy: korydalina i korydyna | ||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||
Bulbokapnina – organiczny związek chemiczny, alkaloid izochinolinowy typu aporfiny, występujący m.in. w bulwach kokoryczy i serduszki. Może powodować śmiertelne zatrucia u owiec i bydła. Jest inhibitorem acetylocholinoesterazy oraz butyrylocholinoesterazy[3]. Hamuje też syntezę dopaminy na drodze inhibicji hydroksylazy tyrozynowej[4][5]. Wykazano także, że bulbokapnina jest antagonistą receptorów dopaminergicznych D1, D2 i D3[6][7][8].
Otrzymywanie
[edytuj | edytuj kod]Bulbokapnina została wyizolowana pod koniec XIX wieku z bulw kokoryczy pustej przez Martina Freunda i Waltera Josephy′ego, którzy wprowadzili jej nazwę i jako pierwsi badali jej właściwości[9]. Synteza chemiczna została opisana w roku 1959 przez Ikuo Kikkawę, który w 5 etapach uzyskał ją z 4-metylenodioksyfenetylaminy i 2-nitro-3-benzyloksy-4-metoksy-ω-diazoacetofenonu[1]:
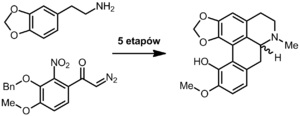
Otrzymany produkt racemiczny o t.topn. ok. 213 °C rozdzielony został na poszczególne enancjomery (t.topn. ok. 202 °C) poprzez krystalizację z kwasem d- lub l-winowym[1].
Zastosowania
[edytuj | edytuj kod]Bulbokapnina była dawniej stosowana w lecznictwie, ze względu na krótkotrwały efekt łagodzenia drżenia w chorobach neurologicznych, w tym w chorobie Parkinsona[10]. Podejmowano też próby zastosowania jej w anestezjologii[11].
Własności biologiczne
[edytuj | edytuj kod]Bulbokapnina jest modelowym kataleptogenem, w badaniach na ssakach podawanie tego alkaloidu wywoływało objawy odpowiadające zespołowi katatonicznemu u ludzi: giętkość woskową, stupor, negatywizm i katalepsję. W bardzo dużych dawkach powoduje napady drgawkowe, sztywność odmóżdżeniową i śmierć. Szczególnie wrażliwe na kataleptogenne działanie alkaloidu są koty (najmniejsza skuteczna dawka wynosi 5 mg/kg masy ciała s.c.)[12].
DeJong wykazał, że bulbokapnina podawana niższym kręgowcom nie posiadającym kory nowej (rybom, płazom, gadom) w dużych dawkach wywoływała objawy hiperkinetyczne, natomiast nigdy nie powodowała katalepsji. U zwierząt chirurgicznie pozbawionych kory wywoływała porażenie bez katalepsji. Katalepsja wywołana bulbokapniną może być zniesiona podaniem leków przeciwparkinsonowskich (amantadyny, triheksyfenidylu), leków o działaniu przeciwhistaminowym (difenhydraminy, prometazyny) oraz leków o działaniu serotoninergicznym (imipramina). Podanie L-DOPY i 5-HTP nasilało objawy katalepsji[12].
Odniesienia w literaturze
[edytuj | edytuj kod]Bohater powieści Nagi lunch Williama S. Burroughsa, doktor Benway, używa bulbokapniny by uzyskać posłuszeństwo torturowanych przez siebie ofiar[13].
Przypisy
[edytuj | edytuj kod]- ↑ a b c Ikuo Kikkawa. Synthesis of Bulbocapnine. „Yakugaku Zasshi”. 79 (10), s. 1244-1248, 1959. (jap.).
- ↑ Bulbocapnine hydrochloride, from Corydalis (nr B6019) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2014-04-25]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ A. Adsersen, A. Kjølbye, O. Dall, A.K. Jäger. Acetylcholinesterase and butyrylcholinesterase inhibitory compounds from Corydalis cava Schweigg. Kort.. „Journal of Ethnopharmacology”. 113 (1), s. 179–182, 2007. DOI: 10.1016/j.jep.2007.05.006. PMID: 17574358.
- ↑ Y.H. Zhang, J.S. Shin, S.S. Lee, S.H. Kim i inni. Inhibition of tyrosine hydroxylase by bulbocapnine. „Planta Medica”. 63 (4), s. 362–363, 1997. DOI: 10.1055/s-2006-957702. PMID: 9270381.
- ↑ J.S. Shin, K.T. Kim, M.K. Lee. Inhibitory effects of bulbocapnine on dopamine biosynthesis in PC12 cells. „Neuroscience Letters”. 244 (3), s. 161–164, 1998. DOI: 10.1016/S0304-3940(98)00148-7. PMID: 9593514.
- ↑ D.R. Burt, I. Creese, S.H. Snyder. Properties of [3H]haloperidol and [3H]dopamine binding associated with dopamine receptors in calf brain membranes. „Molecular Pharmacology”. 12 (5), s. 800–812, 1976. PMID: 995128.
- ↑ J.D. Kohli, D. Glock, L.I. Goldberg. Bulbocapnine is not a selective DA1 receptor antagonist. „Journal of Pharmacy and Pharmacology”. 38 (5), s. 401-402, 1986. DOI: 10.1111/j.2042-7158.1986.tb04599.x. PMID: 2872323.
- ↑ S.B. Freedman, S. Patel, R. Marwood, F. Emms i inni. Expression and pharmacological characterization of the human D3 dopamine receptor. „Journal of Pharmacology and Experimental Therapeutics”. 268 (1), s. 417–426, 1994. PMID: 8301582.
- ↑ Freund M., Josephy W.. Ueber die Alkaloïde, welche in der Wurzel von Corydalis cava (Schwgg.) enthalten sind. „Berichte der deutschen chemischen Gesellschaft”. 25 (2), s. 2411–2415, 1892. DOI: 10.1002/cber.18920250237.
- ↑ H. Jong, G. Schaltenbrand. Die Wirkung des Bulbocapnins auf Paralysis Agitans- und Andere Tremorkranke. „Klinische Wochenschrift”. 3 (45), s. 2045–2049, 1924. DOI: 10.1007/bf01737497.
- ↑ H. Molitor. The Use of Bulbocapnine in Pre-Anesthetic Medication. „Journal of Pharmacology and Experimental Therapeutics”. 56 (1), s. 85-96, 1936.
- ↑ a b A. Loizzo, A.S. De Carolis, V.G. Longo. Studies on the central effects of bulbocapnine. „Psychopharmacologia”. 22 (3), s. 234–249, 1971. DOI: 10.1007/BF00401786. PMID: 5316197.
- ↑ William S. Burroughs, Naked Lunch, James Grauerholz, Barry Miles, David L Ulin, wyd. 50th anniversary ed, New York: Grove Press, 2009, s. 73, ISBN 978-0-8021-1926-1, OCLC 318422237.

