Cesiumkloridi
| Cesiumkloridi | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | CsCl |
| Moolimassa | 168,36 |
| Ulkomuoto | Valkoinen tai väritön kiteinen aine |
| Sulamispiste | 646 °C[1] |
| Kiehumispiste | 1290 °C[1] |
| Tiheys | 3,983 g/cm3[1] |
| Liukoisuus veteen | 1,86 kg/l (20 °C)[1] |
Cesiumkloridi (CsCl) on cesium- ja kloridi-ionien muodostama epäorgaaninen ioniyhdiste.
Kiderakenne
[muokkaa | muokkaa wikitekstiä]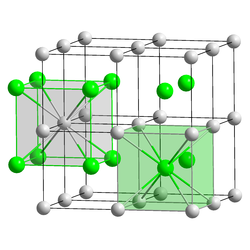
Cesiumkloridin alkeiskoppi on kuutiollinen ja tilakeskeinen. Yhdisteen rakenteessa jokainen cesiumioni on koordinoitunut kahdeksan kloridi-ionin kanssa ja vastaavasti jokainen kloridi-ioni on koordinoitunut kahdeksan cesiumionin kanssa. Rakennetta voidaan kuvata cesium- ja kloridi-ioneista muodostuneina kuutioina, jotka ovat yhtyneet kärjistään. Jokaisen kloridianioneista muodostuneen kuution keskellä on cesiumkationi ja jokaisen cesiumkationeista muodostuneen kuution keskellä on kloridianioni.[2][3]
Valmistus ja käyttö
[muokkaa | muokkaa wikitekstiä]Cesiumkloridia valmistetaan käsittelemällä pollusiittimineraalia suolahapolla ja tämän jälkeen saostamalla cesiumionit jonain niukkaliukoisena kaksoissuolana. Tämä suola hajotetaan joko hydrolyysin tai sulfidisaostuksen avulla, jolloin muodostuu cesiumkloridiliuos. Cesiumkloridia voidaan valmistaa myös neutraloimalla cesiumkarbonaattia tai cesiumhydroksidia.[1]
Cesiumkloridia käytetään muun muassa fotosähköisissä kennoissa. Sillä on käyttöä myös biokemiallisissa tutkimuksissa.[4] Cesiumkloridin ja etidiumbromidin seosta käytetään erottamaan DNA:ta RNA:sta ja proteiineista sentrifugoinnin avulla. Sentrifugoitaessa cesiumkloridiliuosta suurella nopeudella muodostuu tiheysgradientti siten, että liuos on tiheintä koeputken pohjalla. Eri makromolekyyleillä on eri tiheydet. RNA on raskaampaa kuin DNA, jolloin se painuu koeputken pohjalle ja proteiinit jäävät koeputken pinnalle. Etidiumbromidia käytettäessä yksijuosteinen DNA voidaan erottaa kaksijuosteisesta DNA:sta.[5][6]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e William Ferguson & Dena Gorrie: Cesium and Cesium Compounds, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2011 Viitattu 16.8.2012
- ↑ Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 115. Academic Press, 2001. ISBN 978-0-12-352651-9 Kirja Googlen teoshaussa (viitattu 16.08.2012). (englanniksi)
- ↑ Catherine E. Housecroft, Edwin C. Constable: Chemistry: An Introduction to Organic, Inorganic and Physical Chemistry, s. 298. Pearson Education, 2010. ISBN 9780273733089 Kirja Googlen teoshaussa (viitattu 16.08.2012). (englanniksi)
- ↑ Christopher G. Morris: Academic Press dictionary of science and technology, s. 395. Academic Press, 1992. ISBN 978-0-12-200400-1 Kirja Googlen teoshaussa (viitattu 16.08.2012). (englanniksi)
- ↑ Terry Brown: Gene Cloning and DNA Analysis: An Introduction, s. 36. John Wiley & Sons, 2010. ISBN 978-1444334074 Kirja Googlen teoshaussa (viitattu 16.08.2012). (englanniksi)
- ↑ Nukleiinihappojen eristys ja puhdistus Solunetti. Viitattu 16.8.2012.