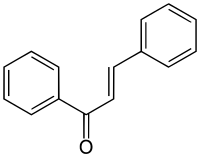
Chalcone
| Chalcone | |
| |
| Identification | |
|---|---|
| Nom UICPA | 1,3-diphénylprop-2-èn-1-one |
| Synonymes |
benzylidènacétophénone |
| No CAS | (mélange des stéréoisomères) (isomère E) |
| No ECHA | 100.009.441 100.002.119, 100.009.441 |
| No CE | 202-330-2 (M.S.) 210-383-8 (E) |
| PubChem | 637760 |
| SMILES | |
| InChI | |
| Apparence | prismes jaune pâle |
| Propriétés chimiques | |
| Formule | C15H12O [Isomères] |
| Masse molaire[1] | 208,255 2 ± 0,013 1 g/mol C 86,51 %, H 5,81 %, O 7,68 %, |
| Propriétés physiques | |
| T° fusion | 57,5 °C[2] ((M.R.) 59 °C[3] (E) |
| T° ébullition | 346,5 °C[2] (M.R.) |
| Solubilité | 92,9 mg·L-1eau, 25 °C, M.R.)[2] |
| Masse volumique | 1,071 g·cm-3 |
| Pression de vapeur saturante | 1,07×10-4 mmHg (M.R.)[2] |
| Précautions | |
| Directive 67/548/EEC | |
| Écotoxicologie | |
| DL50 | 681 mg·kg-1 (M.R., souris, i.p.)[4] 56 mg·kg-1 (M.R., souris, i.v.)[5] 1 048 mg·kg-1 (E, souris, oral)[6] |
| LogP | 3,08 (M.R)[2] 3.660 (E)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La chalcone est une énone aromatique, qui est le noyau d'une classe de composés chimiques au rôle important en biologie, les chalcones. Elle est constituée d'une molécule de prop-2-ènal ou acroléine liée à chaque extrémité à un groupe phényle. La chalcone existe donc sous la forme de deux stéréoisomères (Z et E) en fonction de la disposition des substituants autour de la double liaison centrale.
Synthèse
[modifier | modifier le code]Biosynthèse
[modifier | modifier le code]La chalcone est naturellement synthétisée par un grand nombre de plantes suivant la voie métabolique des phénylpropanoïdes. La phénylalanine est d'abord transformée en acide cinnamique, lui-même transformé en acide paracoumarique qui forme alors un thioester avec le coenzyme A, le 4-coumaroyl-CoA. Ce dernier réagit alors avec 3 molécules de malonyl-coenzyme A qui finissent par se cycliser et former un second groupe phényle, formant ainsi la chalcone.
acide paracoumarique + coenzyme A 4-coumaryl-CoA
4-coumaryl-CoA + 3 malonyl-CoA  + 4 CoA + 3 CO2
+ 4 CoA + 3 CO2
PAL: phénylalanine ammonia-lyase, C4H : cinnamate 4-hydroxylase, 4CL: 4-coumarate-CoA ligase, CHS : chalcone synthase.
La chalcone peut ensuite être transformée par cyclisation interne en flavonoïde.
Réaction proche
[modifier | modifier le code]La naringinine-chalcone (phlorétine) est produite de façon similaire, à partir de 4-coumaroyl-CoA et de 3 molécules de malonyl-coenzyme A, par l'action d'une autre enzyme, la naringinine-chalcone synthase (en).
En laboratoire
[modifier | modifier le code]En laboratoire, la chalcone peut être préparée par crotonisation (condensation aldolique) du benzaldéhyde avec l'acétophénone, réaction catalysée par une base, en général de la soude :
Cette réaction s'est révélée marcher également sans solvant, c'est-à-dire une réaction en phase solide[7]. Cette réaction entre un benzaldéhyde substitué et l'acétophénone a servi de modèle dans le cadre de la chimie verte[8]. Cette réaction, dans ce cadre a aussi été effectuée, à partir des mêmes réactifs, dans l'eau à haute température (entre 200 et 350 °C[9]).
Dérivés
[modifier | modifier le code]La chalcone peut être substituée en de nombreuses positions, par différents groupes. Ces dérivés sont appelés chalcones ou chalconoïdes.

On peut citer l'isoliquiritigénine (2',4',4-trihydroxychalcone), la butéine (3,4,4',6'-tétrahydroxychalcone), le kanakugiol (2′-hydroxy-3′,4′,5′,6′-tétraméthoxychalcone) ou encore la pédicelline (2′,3′,4′,5′,6′-pentaméthoxychalcone).
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Chalcone », sur ChemIDplus
- (en) « Chalcone », sur ChemIDplus
- Indian Journal of Chemistry, Section B: Organic Chemistry, Including Medicinal Chemistry. Vol. 18, Pg. 65, 1979.
- U.S. Army Armament Research & Development Command, Chemical Systems Laboratory, NIOSH Exchange Chemicals. Vol. NX#04476
- Journal of Agricultural and Food Chemistry. Vol. 46, Pg. 1163, 1998.
- Toda, F., et al., J. Chem. Soc. Perkin Trans. I, 1990, 3207.
- Palleros, D. R., J. Chem. Educ., 81, 1345 (2004).
- Comisar, C. M. and Savage, P. E., Green Chem., 6 (2004), 227 - 231. DOI 10.1039/b314622g
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Chalcone » (voir la liste des auteurs).