Chloorpentafluoride
| Chloorpentafluoride | ||||||
|---|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||||
| ||||||
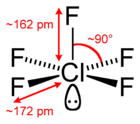
Structuurformule van chloorpentafluoride
| ||||||
| ||||||
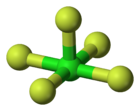
Molecuulmodel van chloorpentafluoride
| ||||||
| Algemeen | ||||||
| Molecuulformule | ClF5 | |||||
| IUPAC-naam | chloorpentafluoride | |||||
| Molmassa | 130,45 g/mol | |||||
| SMILES | FCl(F)(F)(F)F
| |||||
| CAS-nummer | 13637-63-3 | |||||
| EG-nummer | 237-123-6 | |||||
| PubChem | 61654 | |||||
| Wikidata | Q419447 | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
| ||||||
| H-zinnen | H270 - H280 - H330 - H314 | |||||
| EUH-zinnen | EUH071 | |||||
| P-zinnen | P220 - P244 - P260 - P271 - P284 - P280 | |||||
| Omgang | Niet inademen, contact en blootstelling vermijden | |||||
| VN-nummer | 2548 | |||||
| Fysische eigenschappen | ||||||
| Aggregatietoestand | gasvormig | |||||
| Kleur | kleurloos | |||||
| Dichtheid | 5,987 × 10-3 g/cm³ | |||||
| Smeltpunt | −103 °C | |||||
| Kookpunt | −13,1 °C | |||||
| Thermodynamische eigenschappen | ||||||
| ΔfH |
−238,49 kJ/mol | |||||
| S |
310,73 J/mol·K | |||||
| C |
89,16 J/mol·K | |||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
| ||||||
Chloorpentafluoride is een anorganische verbinding met als brutoformule ClF5. Het is een zeer giftig kleurloos gas. Het werd voor het eerst bereid in 1963.[1]
Structuur
[bewerken | brontekst bewerken]De verbinding neemt een vierkant piramidale geometrie aan, die een C4v-symmetrie bezit. De structuur werd bevestigd door middel van haar 19F-NMR-spectrum in hoge resolutie.[2] Chloorpentafluoride is een verbinding van chloor in zijn vijfwaardig positieve oxidatietoestand. Het is een zogenaamd hypervalente verbinding, wat wil zeggen dat het niet voldoet aan de beperkingen van de klassieke Lewisstructuren en de octetregel. Het kan beschreven worden door aan te nemen dat chloor een configuratie met 12 elektronen aanneemt (een valentieschaaluitbreiding) in een pseudo-octaëdrische omringing met vijf chloor-fluorbindingen en één vrij elektronenpaar.
Synthese
[bewerken | brontekst bewerken]Aanvankelijk was de bereidingswijze gebaseerd op de reactie van chloortrifluoride (ClF3) met difluor (F2) bij hoge temperaturen en drukken. Het kan ook gevormd worden door metaalfluoriden MClF4 (bijvoorbeeld KClF4, RbClF4 of CsClF4) te laten reageren met fluorgas. Deze reacties vormen chloorpentafluoride en het overeenkomstige metaalfluoride. In 1981 vonden onderzoekers dat nikkel(II)fluoride (NiF2) een uitstekende katalysator voor de synthese van chloorpentafluoride is.[3]
Reacties
[bewerken | brontekst bewerken]Chloorpentafluoride reageert gemakkelijk met water en vormt daarmee fluorperchloraat (FClO4) en waterstoffluoride (HF). Het is een sterke oxidator, en is daarom gebruikt in raketbrandstof.[4] Hoewel het - behoudens met koolstof - met de niet-metalen van de tweede periode niet reageert, reageert het sterk met zwaardere niet-metalen.[2]
Zie ook
[bewerken | brontekst bewerken]Externe links
[bewerken | brontekst bewerken]- Chloorpentafluoride op Air Liquide[dode link]
- National Pollutant Inventory - Gegevensblad voor fluoride en verwante verbindingen
- WebBook bladzijde voor ClF5
- ↑ Smith D. F. (1963). Chlorine Pentafluoride. Science 141 (3585): 1039–1040. PMID 17739492. DOI: 10.1126/science.141.3585.1039.
- ↑ a b Pilipovich, D., Maya, W., Lawton, E.A., Bauer, H.F., Sheehan, D. F., Ogimachi, N. N., Wilson, R. D., Gunderloy, F. C., Bedwell, V. E. (1967). Chlorine pentafluoride. Preparation and Properties. Inorganic Chemistry 6 (10): 1918. DOI: 10.1021/ic50056a036.
- ↑ Šmalc, A., Žemva, B., Slivnik, J., and Lutar K. (1981). On the Synthesis of Chlorine Pentafluoride. Journal of Fluorine Chemistry 17: 381–383. DOI: 10.1016/S0022-1139(00)81783-2.
- ↑ U.S. Patent 3354646, "Chlorine pentafluoride and method" van 28 november 1967 aan North American Aviation, Inc. Gearchiveerd op 12 juni 2023.




