Citocromo c

O citocromo c (cyt c) é unha pequena hemoproteína que se encontra feblemente asociada coa membrana mitocondrial interna. Pertence á familia do citocormo c de proteínas. O citocromo c é unha proteína moi soluble, o que a diferenza doutros citocromos, xa que ten unha solubilidade duns 100 g/L. É un compoñente esencial da cadea de transporte de electróns, na cal transporta un electrón. Pode sufrir oxidación ou redución ao transferir electróns, pero non se une ao oxíxeno. Transfire electróns entre os Complexos III (coencima Q-citocromo c redutase) e IV (citocromo c oxidase) da cadea respiratoria. Nos humanos, o citocromo c está codificado polo xene CYCS do cromosoma 7.[1][2][3]
Función
[editar | editar a fonte]
O citocromo c é un compoñente da cadea de transporte de electróns mitocondrial. O grupo hemo do citocromo c acepta electróns do complexo do citocromo bc1 e transfíreos ao complexo da citocromo c oxidase. O citocromo c está tamén implicado no inicio da apoptose. Despois de que se libera o ctocromo c no citoplasma, a proteína únese a proteases apoptóticas activando o factor-1 (Apaf-1).[1]
O citocromo c pode catalizar varias reaccións como a hidroxilación e a oxidación aromática, e ten actividade de peroxidase por oxidación de varios doantes de electróns como 2,2-azino-bis(ácido 3-etilbenztiazolina-6-sulfónico) (ABTS), ácido 2-ceto-4-tiometil butírico e 4-aminoantipirina.
Distribución entre as especies
[editar | editar a fonte]O citocromo c é unha proteína moi conservada entre un amplo conxunto de especies, que se encontra en plantas, animais, e moitos organismos unicelulares. Isto, xunto co seu pequeno tamaño (peso molecular de aproximadamente 12.000 daltons),[4] fai que sexa moi útil nos estudos filoxenéticos cladísticos.[5] A súa estruitura primaria consiste nunha cadea duns 100 aminoácidos. En moitos organismos superiores presenta unha cadea de 104 aminoácidos.[6] A súa secuencia de aminoácidos está moi conservada en mamíferos, nos que difire só nuns poucos residuos. Por exemplo, as secuencias dos citocromos c humanos e de chimpancés son idénticas, pero difiren máis comparadas coas do cabalo.[7]
Clases
[editar | editar a fonte]En 1991 R. P. Ambler recoñecía catro clases de citocromos c:[8]
- Clase I. Comprende o citocromo c soluble de baixo spin de mitocondrias e bacterias. Ten o sitio de unión ao hemo cara ao extremo N-terminal e o sexto ligando proporciónao un residuo de metionina cara ao C-terminal.
- Clase II. Inclúe o citocromo c' de alto spin entre outros. Ten o sitio de unión ao hemo cerca do extremo N-terminal.
- Class III. Comprende múltiples citocromos de baixo potencial redox. Os grupos hemo c son estrutural e funcionalmente non equivalentes e presentan diferentes potenciais redox que van de 0 a -400 mV.
- Clase IV. Creada orixinalmente para albergar as proteínas complexas da familia do citocromo c que teñen outros grupos prostéticos distintos do hemo c.
Aplicacións
[editar | editar a fonte]O citocromo c pénsase que é o complexo funcional na chamada terapia láser de baixo nivel (LLLT). Nesta terapia, a luz vermella e algunhas lonxitudes de onda próximas ao infravermello penetran nos tecidos incrementando a rexeneración celular. A luz destas lonxitudes de onda parece capaz de incrementar a actividade do citocromo c, que deste modo aumenta a actividade metabólica e libera máis enerxía para que as células reparen o tecido.[9]
Papel na apoptose
[editar | editar a fonte]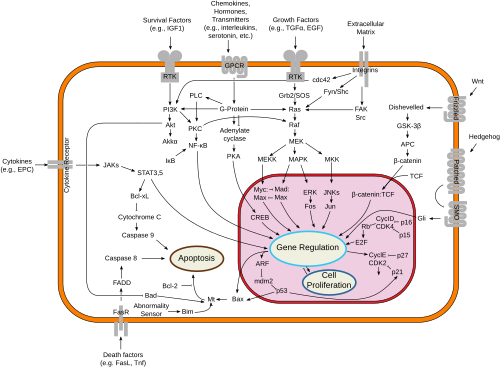
O citocromo c é tamén un intermediario na apoptose, que é unha forma controlada de morte celular utilizada para matar células durante o proceso do desenvolvemento ou en resposta a unha infección ou danos no ADN.[10]
O citocromo c únese á cardiolipina na membrana mitocondrial interna, o que a ancora á membrana e evita que se libere fóra da mitocondria e inicie a apoptose. Aínda que a atracción inicial entre a cardiolipina e o citocromo c é electrostática debido á carga moi positiva que hai sobre o citocromo c, a interacción final é hidrofóbica, xa que unha cola hidrofóbica da cardiolipina se insire na porción hidrofóbica do citocromo c.
Durante a fase inicial da apoptose, está estimulada a produción mitocondrial de especies reactivas do oxíxeno, e a cardiolipina oxídase por unha función peroxidase que ten o complexo cardiolipina–citocromo c. A hemoproteína sepárase despois da membrana mitocondrial interna e pode pasar ao citoplasma soluble a través de poros da membrana externa.[11]
A elevación sostida nos niveis de calcio precede a liberación do citocromo c da mitocondria. A liberación de pequenas cantidades de citocromo c causa unha interacción co receptor IP3 (IP3R) no retículo endoplasmático, causando a liberación de calcio polo retículo endoplasmático. O incremento global de calcio activa unha masiva liberación de citocromo c, o cal despois actúa nun bucle de retroalimentación positivo que mantén a liberación de calcio do retículo endoplasmático a través dos IP3Rs.[12] Isto explica como a liberación de calcio polo retículo endoplasmático pode atinxir niveis citotóxicos. Esta liberación de citocromo c á súa vez activa a caspase 9, que é unha cisteína protease. A caspase 9 pode despois continuar as activacións, activando a caspase 3 e a caspase 7, as cales son responsables de destruír a célula desde dentro.
Localización extramitocondrial
[editar | editar a fonte]En condicións fisiolóxicas acéptase xeneralizadamente que o citocromo c está localizado só no espazo intermembrana mitocondrial.[13] A liberación do citocromo c da mitocondria ao citosol, onde activa a familia das caspases (unhas proteases) crese que é o principal activador que dá lugar ao comezo da apoptose.[14] Porén, estudos microscópicos inmunoelectrónicos detallados con preparacións de tecidos de ratas empregando anticorpos específicos para o citocromo c proporcionaron fortes evidencias de que o citocromo c en condicións normais celulares está tamén presente en localizacións extramitocondriais.[15] Nas células pancreáticas acinares e da pituitaria anterior, detectouse unha presenza forte e específica de citocromo c nos gránulos de cimóxeno e nos gránulos da hormona do crecemento, respectivamente. No páncreas o citocromo c tamén se atopou en vacúolos condensados e no lume dos acinos. A localización extramitocondrial do citocromo c é específica, xa que desaparece completamente despois da adsorción do anticorpo primario co citocromo c purificado.[15] A presenza de citocromo c fóra da mitocondria en localizacións específicas baixo condicións fisiolóxicas normais formula importantes cuestións sobre a súa función celular e os mecanismos de translocación.[15] Ademais de para o citocromo c, esta localización extramitocondrial tamén se observou en moitas outras proteínas mitocondriais incluíndo as codificadas polo propio ADN mitocondrial.[16][17][18] Isto abre a posibilidade de que existan mecanismos específicos para a translocación de proteínas mitocondriais aínda non identidicados que as pasan desde as mitocondrias ao citosol para ir a outros destinos celulares.[18][19]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 "Entrez Gene: cytochrome c".
- ↑ Tafani M, Karpinich NO, Hurster KA, Pastorino JG, Schneider T, Russo MA, Farber JL (March 2002). "Cytochrome c release upon Fas receptor activation depends on translocation of full-length bid and the induction of the mitochondrial permeability transition". J. Biol. Chem. 277 (12): 10073–82. PMID 11790791. doi:10.1074/jbc.M111350200.
- ↑ OMIM Cytochrome c, somatic; CYCS [1]
- ↑ "Cytochrome c - Homo sapiens (Human)". P99999. UniProt Consortium.
mass is 11,749 Daltons
- ↑ Margoliash E (October 1963). "Primary structure and evolution of cytochrome c". Proc. Natl. Acad. Sci. U.S.A. 50: 672–9. PMC 221244. PMID 14077496. doi:10.1073/pnas.50.4.672.
- ↑ Amino acid sequences in cytochrome c proteins from different species Arquivado 28 de decembro de 2013 en Wayback Machine., adapted from Strahler, Arthur; Science and Earth History, 1997. page 348.
- ↑ Lurquin PF, Stone L, Cavalli-Sforza LL (2007). Genes, culture, and human evolution: a synthesis. Oxford: Blackwell. p. 79. ISBN 1-4051-5089-0.
- ↑ Ambler RP (May 1991). "Sequence variability in bacterial cytochromes c". Biochim. Biophys. Acta 1058 (1): 42–7. PMID 1646017. doi:10.1016/S0005-2728(05)80266-X.
- ↑ Silveira PC, Streck EL, Pinho RA. (2005). "Cellular effects of low power laser therapy can be mediated by nitric oxide.". Lasers Surg Med. 36 (4): 307–14. PMID 15739174. doi:10.1002/lsm.20148.
- ↑ Liu X, Kim CN, Yang J, Jemmerson R, Wang X (July 1996). "Induction of apoptotic program in cell-free extracts: requirement for dATP and cytochrome c". Cell 86 (1): 147–57. PMID 8689682. doi:10.1016/S0092-8674(00)80085-9.
- ↑ Orrenius S, Zhivotovsky B (September 2005). "Cardiolipin oxidation sets cytochrome c free". Nat. Chem. Biol. 1 (4): 188–9. PMID 16408030. doi:10.1038/nchembio0905-188.
- ↑ Boehning D, Patterson RL, Sedaghat L, Glebova NO, Kurosaki T, Snyder SH (December 2003). "Cytochrome c binds to inositol (1,4,5) trisphosphate receptors, amplifying calcium-dependent apoptosis". Nat. Cell Biol. 5 (12): 1051–61. PMID 14608362. doi:10.1038/ncb1063.
- ↑ Neupert W (1997). "Protein import into mitochondria". Annu. Rev. Biochem. 66: 863–917. PMID 9242927. doi:10.1146/annurev.biochem.66.1.863.
- ↑ Kroemer G, Dallaporta B, Resche-Rigon M (1998). "The mitochondrial death/life regulator in apoptosis and necrosis". Annu. Rev. Physiol. 60: 619–42. PMID 9558479. doi:10.1146/annurev.physiol.60.1.619.
- ↑ 15,0 15,1 15,2 Soltys BJ, Andrews DW, Jemmerson R, Gupta RS (2001). "Cytochrome-C localizes in secretory granules in pancreas and anterior pituitary". Cell Biol. Int. 25 (4): 331–8. PMID 11319839. doi:10.1006/cbir.2000.0651.
- ↑ Gupta RS, Ramachandra NB, Bowes T, Singh B (2008). "Unusual cellular disposition of the mitochondrial molecular chaperones Hsp60, Hsp70 and Hsp10". Novartis Found. Symp. 291: 59–68; discussion 69–73, 137–40. PMID 18575266.
- ↑ Sadacharan SK, Singh B, Bowes T, Gupta RS (November 2005). "Localization of mitochondrial DNA encoded cytochrome c oxidase subunits I and II in rat pancreatic zymogen granules and pituitary growth hormone granules". Histochem. Cell Biol. 124 (5): 409–21. PMID 16133117. doi:10.1007/s00418-005-0056-2.
- ↑ 18,0 18,1 Soltys BJ, Gupta RS (2000). "Mitochondrial proteins at unexpected cellular locations: export of proteins from mitochondria from an evolutionary perspective". Int. Rev. Cytol. 194: 133–96. PMID 10494626.
- ↑ Soltys BJ, Gupta RS (May 1999). "Mitochondrial-matrix proteins at unexpected locations: are they exported?". Trends Biochem. Sci. 24 (5): 174–7. PMID 10322429.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Kumarswamy R and Chandna S (2009). "Putative partners in Bax mediated cytochrome-c release: ANT, CypD, VDAC or none of them?". Mitochondrion. 9 (1): 1–8. PMID 18992370. doi:10.1016/j.mito.2008.10.003.
- Skulachev VP (1998). "Cytochrome c in the apoptotic and antioxidant cascades.". FEBS Lett. 423 (3): 275–80. PMID 9515723. doi:10.1016/S0014-5793(98)00061-1.
- Mannella CA (1998). "Conformational changes in the mitochondrial channel protein, VDAC, and their functional implications.". J. Struct. Biol. 121 (2): 207–18. PMID 9615439. doi:10.1006/jsbi.1997.3954.
- Ferri KF, Jacotot E, Blanco J, Esté JA, Kroemer G (2000). "Mitochondrial control of cell death induced by HIV-1-encoded proteins". Ann. N. Y. Acad. Sci. 926: 149–64. PMID 11193032. doi:10.1111/j.1749-6632.2000.tb05609.x.
- Britton RS, Leicester KL, Bacon BR (2002). "Iron toxicity and chelation therapy". Int. J. Hematol. 76 (3): 219–28. PMID 12416732. doi:10.1007/BF02982791.
- Haider N, Narula N, Narula J (2003). "Apoptosis in heart failure represents programmed cell survival, not death, of cardiomyocytes and likelihood of reverse remodeling". J. Card. Fail. 8 (6 Suppl): S512–7. PMID 12555167. doi:10.1054/jcaf.2002.130034.
- Castedo M, Perfettini JL, Andreau K, Roumier T, Piacentini M, Kroemer G (decembro de 2003). "Mitochondrial apoptosis induced by the HIV-1 envelope". Ann. N. Y. Acad. Sci. 1010: 19–28. PMID 15033690. doi:10.1196/annals.1299.004.
- Ng S, Smith MB, Smith HT, Millett F (1977). "Effect of modification of individual cytochrome c lysines on the reaction with cytochrome b5". Biochemistry 16 (23): 4975–8. PMID 199233. doi:10.1021/bi00642a006.
- Lynch SR, Sherman D, Copeland RA (1992). "Cytochrome c binding affects the conformation of cytochrome a in cytochrome c oxidase". J. Biol. Chem. 267 (1): 298–302. PMID 1309738.
- Garber EA, Margoliash E (1990). "Interaction of cytochrome c with cytochrome c oxidase: an understanding of the high- to low-affinity transition". Biochim. Biophys. Acta 1015 (2): 279–87. PMID 2153405. doi:10.1016/0005-2728(90)90032-Y.
- Bedetti CD (1985). "Immunocytochemical demonstration of cytochrome c oxidase with an immunoperoxidase method: a specific stain for mitochondria in formalin-fixed and paraffin-embedded human tissues". J. Histochem. Cytochem. 33 (5): 446–52. PMID 2580882. doi:10.1177/33.5.2580882.
- Tanaka Y, Ashikari T, Shibano Y, Amachi T, Yoshizumi H, Matsubara H (xuño de 1988). "Construction of a human cytochrome c gene and its functional expression in Saccharomyces cerevisiae". J. Biochem. 103 (6): 954–61. PMID 2844747.
- Evans MJ, Scarpulla RC (1989). "The human somatic cytochrome c gene: two classes of processed pseudogenes demarcate a period of rapid molecular evolution". Proc. Natl. Acad. Sci. U.S.A. 85 (24): 9625–9. PMC 282819. PMID 2849112. doi:10.1073/pnas.85.24.9625.
- Passon PG, Hultquist DE (1972). "Soluble cytochrome b 5 reductase from human erythrocytes". Biochim. Biophys. Acta 275 (1): 62–73. PMID 4403130. doi:10.1016/0005-2728(72)90024-2.
- Dowe RJ, Vitello LB, Erman JE (1984). "Sedimentation equilibrium studies on the interaction between cytochrome c and cytochrome c peroxidase". Arch. Biochem. Biophys. 232 (2): 566–73. PMID 6087732. doi:10.1016/0003-9861(84)90574-5.
- Michel B, Bosshard HR (1984). "Spectroscopic analysis of the interaction between cytochrome c and cytochrome c oxidase". J. Biol. Chem. 259 (16): 10085–91. PMID 6088481.
- Broger C, Nałecz MJ, Azzi A (1980). "Interaction of cytochrome c with cytochrome bc1 complex of the mitochondrial respiratory chain". Biochim. Biophys. Acta 592 (3): 519–27. PMID 6251869. doi:10.1016/0005-2728(80)90096-1.
- Smith HT, Ahmed AJ, Millett F (1981). "Electrostatic interaction of cytochrome c with cytochrome c1 and cytochrome oxidase". J. Biol. Chem. 256 (10): 4984–90. PMID 6262312.
- Geren LM, Millett F (1981). "Fluorescence energy transfer studies of the interaction between adrenodoxin and cytochrome c". J. Biol. Chem. 256 (20): 10485–9. PMID 6270113.
- Favre B, Zolnierowicz S, Turowski P, Hemmings BA (1994). "The catalytic subunit of protein phosphatase 2A is carboxyl-methylated in vivo". J. Biol. Chem. 269 (23): 16311–7. PMID 8206937.
- Gao B, Eisenberg E, Greene L (1996). "Effect of constitutive 70-kDa heat shock protein polymerization on its interaction with protein substrate". J. Biol. Chem. 271 (28): 16792–7. PMID 8663341. doi:10.1074/jbc.271.28.16792.
Ligazóns externas
[editar | editar a fonte]- A proteína citocromo c
- Apoptosis & Caspase 3 - Animación do PMAP
- Universidade de Míchigan superfamily 78 - Orientacións calculadas dos citocromos c na bicapa lipídica.
- Cytochrome c Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
