Difluor-klórmetán
| Difluor-klórmetán | |||
 |

| ||
| Más nevek | HCFC-22, R-22, Freon 22 | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 75-45-6 | ||
| PubChem | 6372 | ||
| ChemSpider | 6132 | ||
| EINECS-szám | 200-871-9 | ||
| KEGG | C19361 | ||
| RTECS szám | PA6390000 | ||
| |||
| |||
| InChIKey | VOPWNXZWBYDODV-UHFFFAOYSA-N | ||
| UNII | ZFO627O6CN | ||
| ChEMBL | 116155 | ||
| Kémiai és fizikai tulajdonságok | |||
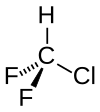
| Kémiai képlet | CHClF2 | ||
| Moláris tömeg | 86,47 g/mol | ||
| Megjelenés | színtelen gáz | ||
| Szag | édeskés[1] | ||
| Sűrűség | 3,66 kg/m3 (15 °C-on, gáz) | ||
| Olvadáspont | −175,42 °C | ||
| Forráspont | −40,7 °C | ||
| Oldhatóság (vízben) | 0,7799 (V/V) 25 °C-on; 3,628 g/l | ||
| Mágneses szuszceptibilitás | −38,6·10−6 cm3/mol | ||
| Gőznyomás | 908 kPa (20 °C-on) | ||
| kH | 0,033 mol⋅kg−1⋅bar−1 | ||
| Megoszlási hányados | 1,08 | ||
| Kristályszerkezet | |||
| Molekulaforma | tetraéderes | ||
| Veszélyek | |||
| Főbb veszélyek | környezetre veszélyes (N), központi idegrendszeri depresszáns, Carc. Cat. 3 | ||
| NFPA 704 | |||
| Lobbanáspont | nem gyúlékony | ||
| PEL | nincs[1] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A difluor-klórmetán (HCFC-22 vagy R-22 kóddal is jelölik) a részlegesen klórozott-fluorozott szénhidrogének (HCFC-k) közé tartozó szerves vegyület. Színtelen gáz, képlete CHClF2. Hajtógázként és hűtőközegként alkalmazzák. A fejlett országokban ezirányú alkalmazása – ózonrétegre káros, valamint üvegházgáz volta miatt – visszaszorulóban van, de a felhasznált összmennyisége még így is növekszik a fejlődő országok nagy igénye miatt.[2] A vegyipar is felhasználja, a tetrafluoretilén gyártásának kiindulási anyaga.
Előállítása és felhasználása
[szerkesztés]2008-ban a világ éves termelése mintegy 800 ezer tonna volt (ez az 1998-as 450 ezer tonna kétszerese), melyet nagyobb részt a fejlődő országokban állítottak elő,[2] ahol felhasználása tovább emelkedik, főként a légkondícionálók terjedése miatt: Indiában és Kínában ezek eladása évente 20%-kal nő.
Kloroformból állítják elő:
- HCCl3 + 2 HF → HCF2Cl + 2 HCl
További felhasználása a tetrafluoretilén előállítása, melyet pirolízissel, majd az így keletkezett difluorkarbén dimerizálásával végeznek[3]
- 2 CHClF2 → C2F4 + 2 HCl
Jegyzetek
[szerkesztés]- ↑ a b c d e NIOSH Pocket Guide to Chemical Hazards #0124. National Institute for Occupational Safety and Health (NIOSH)
- ↑ a b „Relief in Every Window, but Global Worry Too”, The New York Times , 2012. június 20.. [2012. június 21-i dátummal az eredetiből archiválva] (Hozzáférés: 2012. június 21.)
- ↑ Ullmann Vegyipari Enciklopédia
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Chlorodifluoromethane című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.

