Endomètre
| Système |
|---|
| Nom latin |
Tunica mucosa |
|---|---|
| MeSH |
D004717 |
| TA98 |
A09.1.03.027 |
| TA2 |
3521 |
| FMA |
17742 |
L'endomètre est la couche interne épithéliale de l'utérus chez les mammifères, accompagnée de sa membrane muqueuse. Il consiste en deux couches : une basale et une fonctionnelle. La couche fonctionnelle se renouvelle à partir de cellules souches[1] puis est évacuée lors de la menstruation chez les humains et certains mammifères, dont les grands singes, les primates de l'ancien monde, certaines espèces de chauve-souris, le musaraigne-éléphant[2] et le rat épineux du Caire[3]. Chez la plupart des autres mammifères, l'endomètre est réabsorbé à la fin de l'œstrus. Lors d'une grossesse, les glandes deviennent plus nombreuses et l'endomètre devient aussi richement vascularisé pour accueillir un embryon lors de la nidation. Il est alors parfois appelé dentelle utérine. L'endomètre participe avec l'embryon à la constitution du placenta, qui apporte de l'oxygène et des nutriments au fœtus[4],[5]. L'hypothèse d'un microbiote endométrial[6] est contestée[7],[8].
Structure
[modifier | modifier le code]
L'endomètre consiste en une couche simple d'épithélium cylindrique sur un tissu conjonctif, ce dernier étant aussi appelé stroma dans la littérature scientifique. L'épaisseur de ce tissu conjonctif évolue en fonction des niveaux d'hormones. A l'intérieur de l'utérus, des glandes cylindriques simples vont de la surface de l'endomètre jusqu'à la base du tissu conjonctif, qui acheminent aussi un apport sanguin depuis les artères spiralées utérines. Chez une personne avec un utérus et en âge de procréer, deux couches d'endomètre peuvent être distinguées. Ces deux couches sont présentes uniquement à l'intérieur de l'utérus, et non à l'intérieur des tubes utérins (anciennement appelés trompes de Fallope)[4],[5].
- La couche fonctionnelle est adjacente à la cavité utérine. Cette couche se développe à partir de cellules souches[1] à la fin des menstruations, dans la première partie du cycle menstruel. La prolifération des cellules d'endomètre, qui donne son épaississement, est provoquée par de l'œstrogène produit par les ovaires : il s'agit de la phase folliculaire du cycle menstruel. Ensuite, lors de la phase lutéale, des modifications à cette couche seront induites par du progestérone provenant du corps jaune (corpus luteum). L'endomètre est alors un environnement optimal pour l'implantation et la croissance d'un embryon. Sans embryon, cette couche se désintègre pour être évacuée lors des menstruations.
- La couche basale, sous la couche fonctionnelle et adjacente au myomètre, n'est jamais évacuée. Les cellules souches qui s'y trouvent, développent la couche fonctionnelle qui la couvre.
En absence de progestérone, les artères qui acheminent du sang à la couche fonctionnelle se resserrent, provoquant une ischémie qui mène au décès des cellules d'endomètre et une menstruation.
Il est possible d'identifier la phase du cycle menstruel en se référant au cycle ovarien ou au cycle utérin par l'observation de différences microscopiques lors de chaque phase. Par exemple, dans le cycle ovarien :
| Phase | Jours | Epaisseur | Epithélium |
|---|---|---|---|
| Phase menstruelle | 1–5 | Fine | Absent |
| Phase folliculaire | 5–14 | Moyenne | Cylindrique |
| Phase lutéale | 15–27 | Epaisse | Cylindrique. Les vaisseaux arqués de l'utérus sont également visibles. |
| Phase ischémique | 27–28 | Cylindrique. Les vaisseaux arqués de l'utérus sont également visibles. |
Expression des gènes et des protéines
[modifier | modifier le code]Environ 20,000 gènes codants pour les protéines s'expriment dans les cellules humaines, dont ~70% s'expriment dans l'endomètre normal[9],[10]. Une centaine de ces gènes s'expriment plus spécifiquement dans l'endomètre, avec seulement une poignée hautement spécifiques à l'endomètre lui-même. Les protéines qui y correspondent spécifiquement s'expriment dans les cellules glandulaires et stromales de la muqueuse endométriale. L'expression de plusieurs de ces protéines peut varier en fonction du cycle menstruel, par exemple le récepteur de la progestérone et celui de l'hormone thyréotrope qui s'expriment tous les deux lors de la phase proliférative, et la protéine endométriale associée aux progestogènes qui s'exprime lors de la phase de sécrétion. D'autres protéines, telles que la protéine de boîte homéotique HOX-A11 qui est nécessaire à la fertilité chez les femmes et les femelles, s'expriment dans les cellules stromales d'endomètre pendant tout le cycle menstruel. Certaines protéines spécifiques comme le récepteur d'œstrogène s'expriment aussi dans d'autres types de tissus spécifiques aux femmes et aux femelles, tels que le col de l'utérus, les tubes utérins, les ovaires et les seins[11].
Fonction
[modifier | modifier le code]L'endomètre est la couche interne de l'utérus, consiste lui-même en deux couches (la couche basale et la couche fonctionnelle - voir Structure), et empêche la formation d'adhérences entre les parois du myomètre, maintenant ainsi la perméabilité de la cavité utérine. Pendant le cycle menstruel ou l'œstrus, l'endomètre s'épaissit et s'alimente en vaisseaux sanguins. Ainsi est créée la couche fonctionnelle, un environnement optimal pour l'implantation d'un blastocyste à son arrivée dans l'utérus. L'implantation peut se produire dans n'importe quel tissu du corps humain (cas des grossesses extra-utérines spontanées, par exemple) ; l'endomètre est un des rares tissus dans lequel un blastocyste ne peut pratiquement pas s'implanter excepté durant la fenêtre implantoire[12]. L'endomètre est central, échogène (peut être détecté par échographie), et chez les personnes avec un utérus, il a une épaisseur moyenne de 6,7 mm (épaisseur moyenne différente chez d'autres espèces).
Lors d'une grossesse, les glandes et vaisseaux sanguins de l'endomètre continuent d'augmenter en taille et en nombre. Des espaces vasculaires fusionnent et deviennent interconnectés, formant le placenta, qui fournit de l'oxygène et des nutriments à l'embryon et au fœtus.
Cycle
[modifier | modifier le code]La couche fonctionnelle de l'endomètre est régénérée à partir de cellules souches[1], de façon cyclique. Les humains, les grands singes, et certains autres espèces ont un cycle menstruel, alors que la plupart des mammifères ont un œstrus[2]. Dans les deux cas, en début de cycle l'endomètre prolifère sous l'influence de l'œstrogène. Une fois qu'il y a ovulation, le corps jaune produit des quantités de progestérone. Cela modifie la prolifération de l'endomètre, qui devient sécréteur ; on parle alors de la phase lutéale. Cette couche sécrétrice est un environnement idéal pour un ou plusieurs blastocystes.
Une fois l'ovule fécondé, il pourra s'implanter dans la paroi de l'utérus et interagir avec le corps du parent par le biais de l'hormone chorionique gonadotrope humaine (hCG). L'hCG fournit une rétroaction continue tout au long de la grossesse en maintenant le corps jaune, qui continue à sécréter du progestérone et de l'œstrogène. S'il y a implantation, l'endomètre se transforme en caduque. Cette caduque basale fera partie du placenta, qui soutient et protège la gestation.
Sans fécondation et/ou implantation, chez la plupart des mammifères l'endomètre est réabsorbé à la fin de l'œstrus. Chez les espèces ayant un cycle menstruel, l'endomètre est évacué. Dans ce cas, le processus d'évacuation commence par la décomposition de la muqueuse, la déchirure de petits vaisseaux sanguins conjonctifs, avec ensuite la perte des tissus et du sang qui l'avaient constitué à travers le vagin. L'ensemble du processus se déroule sur une période de plusieurs jours. Les menstruations peuvent être accompagnées d'une série de contractions utérines ; celles-ci aident à expulser l'endomètre menstruel.
Sans stimulation de l'endomètre par des hormones, l'endomètre reste mince et la couche basale est inactive. Chez l'humain, cela s'appelle l'aménorrhée, l'absence de menstruations. Après la ménopause, l'endomètre est parfois décrite comme étant atrophique. L'utilisation à long terme d'une contraception orale contenant une forte dose de progestatifs peut également induire une atrophie de l'endomètre. En contraste, l'endomètre exposé à des œstrogènes de manière chronique, mais sans progestérone, peut devenir hyperplasique[13],[14].
Le cycle menstruel chez l'humain dure en moyenne 28 jours. L'endomètre se développe sur des cycles différents chez d'autres mammifères ayant un cycle menstruel. Divers facteurs peuvent affecter son développement, tels que les saisons, le climat, ou le stress. Comme vu dans le paragraphe Structure, l'endomètre produit aussi certains hormones à différentes étapes du cycle, ce qui interagit avec l'organisme.
Pathologies liées
[modifier | modifier le code]- Cancer de l'endomètre : appelé aussi cancer du corps utérin, cancer qui se développe à partir de l'endomètre
- Endométriose : présence de glandes et de tissus similaires à l'endomètre, en dehors de l'utérus
- Adénomyose : invasion du myomètre et parfois aussi du périmètre de l'utérus par l'endomètre
- Hyperplasie de l'endomètre : prolifération bénigne de l'endomètre dans l'utérus
- Syndrome d'Asherman : maladie utérine acquise, caractérisée par la formation d'adhérences (tissu de cicatrisation) dans l'utérus
Autres images
[modifier | modifier le code]-
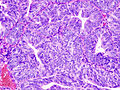
Adénocarcinome endométrioïde, vue d'une biopsie. Coloration HE.
-
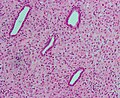
Micrographie d'endomètre décidualisé en raison de progestérone exogène. Coloration HE.
-
Micrographie d'endomètre décidualisé en raison de progestérone exogène. Coloration HE.
-
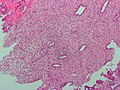
Micrographie montrant la condensation stromale de l'endomètre, observée lors des menstruations.
Voir aussi
[modifier | modifier le code]Références
[modifier | modifier le code]- (en) C.E. Gargett, K.E. Schwab, R.M. Zillwood, H.P. Nguyen et D. Wu, « Isolation and culture of epithelial progenitors and mesenchymal stem cells from human endometrium. », Biology of Reproduction, vol. 80, no 6, , p. 1136–1145 (PMID 19228591, PMCID 2849811, DOI 10.1095/biolreprod.108.075226)
- (en) D Emera, R Romero et G Wagner, « The evolution of menstruation: a new model for genetic assimilation: explaining molecular origins of maternal responses to fetal invasiveness. », BioEssays, vol. 34, no 1, , p. 26–35 (PMID 22057551, PMCID 3528014, DOI 10.1002/bies.201100099)
- (en) N. Bellofiore, S. Ellery, J. Mamrot, D. Walker, P. Temple-Smith et H. Dickinson, « First evidence of a menstruating rodent: the spiny mouse (Acomys cahirinus) », bioRxiv, vol. 216, no 1, , p. 40.e1–40.e11 (PMID 27503621, DOI 10.1101/056895, S2CID 196624853, lire en ligne)
- Blue Histology - Female Reproductive System. School of Anatomy and Human Biology — The University of Western Australia Accessed 20061228 20:35
- AC Guyton et JE Hall, Textbook of Medical Physiology, Elsevier Saunders, , 1018ff (ISBN 9780721602400), « Chapter 81 Female Physiology Before Pregnancy and Female Hormones »
- (en) Jason M. Franasiak et Richard T. Scott, « Reproductive tract microbiome in assisted reproductive technologies », Fertility and Sterility, vol. 104, no 6, , p. 1364–1371 (ISSN 0015-0282, PMID 26597628, DOI 10.1016/j.fertnstert.2015.10.012)
- (en) JM Baker, DM Chase et MM Herbst-Kralovetz, « Uterine Microbiota: Residents, Tourists, or Invaders? », Frontiers in Immunology, vol. 9, , p. 208 (PMID 29552006, PMCID 5840171, DOI 10.3389/fimmu.2018.00208)
- (en) ME Perez-Muñoz, MC Arrieta, AE Ramer-Tait et J Walter, « A critical assessment of the "sterile womb" and "in utero colonization" hypotheses: implications for research on the pioneer infant microbiome. », Microbiome, vol. 5, no 1, , p. 48 (PMID 28454555, PMCID 5410102, DOI 10.1186/s40168-017-0268-4)
- (en) « The human proteome in endometrium - The Human Protein Atlas », sur proteinatlas.org (consulté le )
- (en) Mathias Uhlén, Linn Fagerberg, Björn M. Hallström, Cecilia Lindskog, Per Oksvold, Adil Mardinoglu, Åsa Sivertsson, Caroline Kampf et Evelina Sjöstedt, « Tissue-based map of the human proteome », Science, vol. 347, no 6220, , p. 1260419 (ISSN 0036-8075, PMID 25613900, DOI 10.1126/science.1260419, S2CID 802377)
- (en) Agata Zieba, Evelina Sjöstedt, Matts Olovsson, Linn Fagerberg, Björn M. Hallström, Linda Oskarsson, Karolina Edlund, Anna Tolf et Mathias Uhlen, « The Human Endometrium-Specific Proteome Defined by Transcriptomics and Antibody-Based Profiling », OMICS: A Journal of Integrative Biology, vol. 19, no 11, , p. 659–668 (PMID 26488136, DOI 10.1089/omi.2015.0115)
- N. Lédée, « Réceptivité endométriale », Physiologie, pathologie et thérapie de la reproduction chez l'humain, , p. 163–170 (ISBN 978-2-8178-0060-8)
- (en) L. Deligdisch, « Effects of hormone therapy on the endometrium », Modern Pathology, vol. 6, no 1, , p. 94–106 (PMID 8426860)
- William's Gynecology, McGraw 2008, Chapter 8, Abnormal Uterine Bleeding