Ethylacetaat
| Ethylacetaat | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
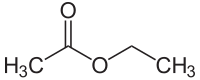
Structuurformule van ethylacetaat
| ||||

| ||||
Proton-NMR-spectrum van ethylacetaat
| ||||
| Algemeen | ||||
| Molecuulformule | C4H8O2 | |||
| IUPAC-naam | ethylethanoaat | |||
| Andere namen | azijnzure ethylester, azijnether, ESTP, acetoxyethaan, acetidine | |||
| Molmassa | 88,10512 g/mol | |||
| SMILES | CCOC(=O)C
| |||
| InChI | 1/C4H8O2/c1-3-6-4(2)5/h3H2,1-2H3
| |||
| CAS-nummer | 141-78-6 | |||
| EG-nummer | 205-500-4 | |||
| PubChem | 8857 | |||
| Wikidata | Q407153 | |||
| Beschrijving | Kleurloze vloeistof met een typerende geur | |||
| Vergelijkbaar met | azijnzuur, ethanol | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H225 - H319 - H336 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 - P261 - P305+P351+P338 | |||
| Omgang | Dampen niet inademen, contact vermijden. | |||
| Opslag | Verwijderd houden van hitte, vonken of open vlammen. | |||
| EG-Index-nummer | 607-022-00-5 | |||
| VN-nummer | 1173 | |||
| ADR-klasse | Gevarenklasse 3 | |||
| MAC-waarde | 1400 mg/m³ | |||
| LD50 (ratten) | (oraal) 5620 mg/kg | |||
| LD50 (konijnen) | (oraal) 4935 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 0,897 g/cm³ | |||
| Smeltpunt | −83,6 °C | |||
| Kookpunt | 77,1 °C | |||
| Vlampunt | −3 °C | |||
| Dampdruk | 9700 Pa | |||
| Oplosbaarheid in water | 83 g/L | |||
| Goed oplosbaar in | aceton, ethanol, di-ethylether, benzeen | |||
| Slecht oplosbaar in | water | |||
| log(Pow) | 0,67 | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 1,78 D | |||
| Nutritionele eigenschappen | ||||
| ADI | 6 mg/kg lichaamsgewicht | |||
| Type additief | geurstof | |||
| E-nummer | E1504 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Ethylacetaat is de ester van ethanol en azijnzuur. De systematische IUPAC-naam is ethylethanoaat. Deze kleurloze vloeistof heeft een karakteristieke zoete geur, bekend van bepaalde lijmen en nagellakverwijderaar. Ethylacetaat, soms afgekort als EtOAc of AcOEt, wordt op grote schaal geproduceerd.
Synthese
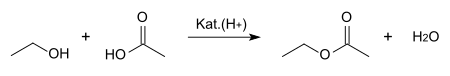
[bewerken | brontekst bewerken]Ethylacetaat wordt bereid via een verestering van azijnzuur en ethanol, in aanwezigheid van een zure katalysator zoals zwavelzuur:
De aanwezigheid van zwavelzuur verhindert tevens dat door het ontstane water het evenwicht weer naar links wordt verschoven. In een waterige omgeving is de verestering namelijk een evenwichtsreactie.
In het laboratorium kan eenvoudig een geconcentreerde azijnzuuroplossing gemengd worden met een gelijke hoeveelheid (naar volume) tot azeotroop (96%) gedestilleerde ethanol, in aanwezigheid van een hoeveelheid zwavelzuur die genoeg is om water weg te houden. De oplossing wordt een aantal uur gerefluxt bij een temperatuur van 70-80 °C. Ook kan men een mengsel van ethanol, azijnzuur, zoutzuur en watervrij calciumchloride refluxen. Dit levert eveneens het zuivere product op. Aan het einde van het experiment zouden er twee lagen (water onderaan en ethylacetaat bovenaan) gevormd moeten zijn. Soms vindt er geen duidelijke scheiding plaats van de ethylacetaat. De oplossing kan dan in koud gedestilleerd water gegoten worden. De twee lagen kunnen worden gescheiden door een scheid-trechter of toevoegtrechter.
Eigenschappen
[bewerken | brontekst bewerken]Ethylacetaat is een licht polair oplosmiddel dat de voordelen heeft dat het vluchtig, relatief weinig giftig, en niet hygroscopisch is. Het is een zwakke waterstofbrugacceptor en -donor. Ethylacetaat kan 3% water oplossen en heeft een oplosbaarheid van 8% in water bij kamertemperatuur. Bij hogere temperaturen is het in hogere mate mengbaar. Door het feit dat het een ester is, hydrolyseert het in aanwezigheid van sterke zuren en basen.
Toepassingen
[bewerken | brontekst bewerken]Ethylacetaat is een veel gebruikt oplosmiddel voor chemische reacties en voor extracties. Het is aanwezig in nagellakken en nagellakverwijderaar en kan worden gebruikt voor de verwijdering van cafeïne uit koffiebonen en theebladeren, hoewel dit meestal met vloeibaar CO2 gebeurt (cafeïne-extractie met superkritisch koolstofdioxide).
Ethylacetaat is ook aanwezig in snoep, parfums, en vruchten omdat het een fruitachtige geur heeft, net als vele andere esters.
Voorkomen in wijnen
[bewerken | brontekst bewerken]Ethylacetaat komt voor in wijnen. Bij te hoge concentraties kan het als vervuiling gezien worden, zoals vaak gebeurt wanneer wijn voor een lange periode is blootgesteld aan lucht. Ook komt het soms voor in bier, als vergistingsproduct[bron?].
Overige toepassingen
[bewerken | brontekst bewerken]Ethylacetaatdamp is een effectief vergif dat gebruikt wordt door entomologen en andere verzamelaars van insecten. In een stikpot met ethylacetaat doden de dampen het gevangen insect snel zonder het insect zelf aan te tasten. Lijkstijfheid treedt minder op dan bij andere middelen zoals di-ethylether.
Ethylacetaat wordt ook vaak gebruikt als eluens in chromatografische analyses zoals TLC.
Externe links
[bewerken | brontekst bewerken] ethylacetaat - International Chemical Safety Card
ethylacetaat - International Chemical Safety Card- (en) MSDS van ethylacetaat
- (en) Gegevens van ethylacetaat in de GESTIS-stoffendatabank van het IFA