Ethylphenole
Die Ethylphenole bilden eine Stoffgruppe, die sich sowohl vom Phenol als auch vom Ethylbenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Hydroxygruppe (–OH) und Ethylgruppe (–CH2–CH3) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C8H10O. In erster Linie kann man sie als ethylsubstituierte Phenole ansehen.
Vertreter
[Bearbeiten | Quelltext bearbeiten]| Ethylphenole | ||||||||
| Name | 2-Ethylphenol | 3-Ethylphenol | 4-Ethylphenol | |||||
| Andere Namen | 2-Ethylhydroxybenzol | 3-Ethylhydroxybenzol | 4-Ethylhydroxybenzol | |||||
| Strukturformel | 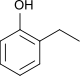
|
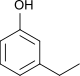
|
||||||
| CAS-Nummer | 90-00-6 | 620-17-7 | 123-07-9 | |||||
| PubChem | 6997 | 12101 | 31242 | |||||
| FL-Nummer | 04.070 | 04.021 | 04.022 | |||||
| Summenformel | C8H10O | |||||||
| Molare Masse | 122,16 g·mol−1 | |||||||
| Aggregatzustand | flüssig | fest | ||||||
| Beschreibung | gelbbraune Flüssigkeit[1] | hellgelbe Flüssigkeit[2] | gelber Feststoff[3] | |||||
| Schmelzpunkt | −18 °C[1] | −4 °C[2] | 40–42 °C[3] | |||||
| Siedepunkt | 207 °C[4] | 217 °C[4] | 219 °C[4] | |||||
| Dichte | 1,037 g/ml (25 °C)[5][6] | 1,001 g/ml (25 °C)[2] | 0,98 g/ml (25 °C)[7] | |||||
| Dampfdruck | 0,17 hPa (20 °C)[3] | |||||||
| Löslichkeit | 4,9 g/l (25 °C)[8] | |||||||
| pKs-Wert[4] | 10,2 | 9,90 | 10,01 | |||||
| GHS- Kennzeichnung |
|
|
| |||||
| H- und P-Sätze | 302‐315‐318‐335 | 302+312+332‐314 | 314 | |||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||||
| 261‐280‐305+351+338 | 280‐305+351+338‐310 | 280‐305+351+338‐310 | ||||||
| LD50 | 600 mg/kg (Maus, oral)[5] | 138 mg/kg (Maus, i.p.)[3] | ||||||
Vorkommen
[Bearbeiten | Quelltext bearbeiten]2-Ethylphenol kommt natürlich in Kaffee (Coffea arabica),[9] Meerträubel (Ephedra sinica)[9] und Artemisia (Artemisia capillaris),[10] 4-Ethylphenol kommt natürlich in Kaffee (Coffea arabica)[11] und Mais (Zea mays)[11] vor.
Darstellung
[Bearbeiten | Quelltext bearbeiten]o- und p-Ethylphenol
[Bearbeiten | Quelltext bearbeiten]Die Synthese von o- und p-Ethylphenol geht vom Ethylbenzol aus, das durch eine Friedel-Crafts-Alkylierung aus Benzol und Bromethan mit Aluminiumchlorid als Katalysator hergestellt werden kann. Nitrierung mit Salpetersäure und Schwefelsäure führt zu einem Gemisch von o-Ethylnitrobenzol und p-Ethylnitrobenzol, das mit Eisen und Salzsäure zu den entsprechenden Ethylanilinen reduziert wird. Die Trennung der beiden Isomere wird nach Acetylierung der Aminogruppen durch Essigsäureanhydrid durchgeführt – das p-Isomer ist schlecht wasserlöslich, wohingegen das o-Isomer in Lösung bleibt. Durch Kochen mit Salzsäure werden die Amide verseift und nach einer Diazotierung mit Natriumnitrit und anschließendem Verkochen des Diazoniumsalzes werden die gewünschten Verbindungen erhalten.[6]
m-Ethylphenol
[Bearbeiten | Quelltext bearbeiten]Ein Syntheseweg von m-Ethylphenol geht vom p-Ethylanilin aus, das mit Essigsäureanhydrid acetyliert wird, um nach anschließender Nitrierung und Verseifung des Amids mit Salzsäure 4-Ethyl-2-nitroanilin zu erhalten. Die Aminogruppe wird diazotiert und mit Schwefelsäure entfernt, das dabei entstehende 3-Ethylnitrobenzol wird mit Eisen und Salzsäure zum m-Ethylanilin reduziert. Erneutes Diazotieren und Verkochen des Diazoniumsalzes liefert das gewünschte m-Ethylphenol.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das 4-Ethylphenol, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. Es ist im Gegensatz zu den anderen beiden Isomeren ein Feststoff. Die Ethylgruppe hat nur geringen Einfluss auf die Acidität der phenolischen OH-Gruppe, die pKs-Werte weisen nur geringfügige Unterschiede zum Phenol (9,99[4]) auf.
Bedeutung im Wein
[Bearbeiten | Quelltext bearbeiten]Der Hefepilz Brettanomyces bruxellensis ist u. a. verantwortlich für einen Weinfehler, vor allem in Rotweinen. Die geschmacksbildenden Substanzen sind hier 4-Ethylphenol, zusammen mit 4-Ethylguajacol und 4-Ethylcatechol. Die Wahrnehmungsschwelle von 4-Ethylphenol liegt bei 440 µg pro Liter. Die Substanz wird mit einem Lackgeruch, nach Pferdeschweiß riechend, phenolisch oder ledrig wahrgenommen.[12] Ende der 1960er-Jahre wurde 4-Ethylphenol zum ersten Mal von Albert Dinsmoor Webb und Mitarbeitern im Wein nachgewiesen.[13]
Biochemisch wird 4-Ethylphenol aus p-Cumarsäure in einem zweistufigen Prozess erzeugt.[14][12] Hierbei wird p-Cumarsäure zu Vinylphenol decarboxyliert und dann zu 4-Ethylphenol oxidiert. Die erste Reaktion wird von in Brettanomyces von einer Hydroxyzimtsäure-Decarboxylase, die zweite von einer Vinylphenolreduktase katalysiert.
Analytischer Nachweis
[Bearbeiten | Quelltext bearbeiten]Mit Eisen(III)-chlorid bildet o-Ethylphenol eine blauviolette Färbung, m-Ethylphenol eine violette Färbung und p-Ethylphenol eine blaue Färbung. m-Ethylphenol bildet mit Essigsäureanhydrid ein flüssiges Acetat, das fruchtartig riecht und einen Siedepunkt bei 222–223 °C hat.[6] Der qualitativ-analytische Nachweis kann auch über die leicht herstellbaren Benzoylderivate durchgeführt werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt 2-Ethylphenol bei Alfa Aesar, abgerufen am 16. August 2010 (Seite nicht mehr abrufbar).
- ↑ a b c d Datenblatt 3-Ethylphenol bei Sigma-Aldrich, abgerufen am 8. November 2016 (PDF).
- ↑ a b c d e Datenblatt 4-Ethylphenol bei Sigma-Aldrich, abgerufen am 8. November 2016 (PDF).
- ↑ a b c d e CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b c Datenblatt 2-Ethylphenol bei Sigma-Aldrich, abgerufen am 8. November 2016 (PDF).
- ↑ a b c d A. Béhal, E. Choay: Sur les éthylphénols. In: Compt. Rend. Hebd., 118, 1894, S. 422–425 (Digitalisat auf Gallica).
- ↑ Datenblatt 4-Ethylphenol bei Merck, abgerufen am 16. August 2010.
- ↑ Eintrag zu 4-Ethylphenol bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b 2-ETHYLPHENOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 13. August 2023.
- ↑ O-ETHYLPHENOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 13. August 2023.
- ↑ a b 4-ETHYLPHENOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 13. August 2023.
- ↑ a b Riccardo Flamini und Pietro Traldi: Mass Spectrometry in Grape and Wine Chemistry. John Wiley & Sons; 2010. ISBN 978-0-470-39247-8; S. 145.
- ↑ A. D. Webb: Wine flavor: Volatile aroma compounds of wines. In: H. W. Schultz (Hrsg.), E. A. Day (Hrsg.), L. M. Libbey (Hrsg.): The chemistry and physiology of flavours. The AVI Publishing Company Inc., Westport Co (1967).
- ↑ Brettanomyces Monitoring by Analysis of 4-ethylphenol and 4-ethylguaiacol at etslabs.com

