Glukonolakton
| Glukonolakton | |
|---|---|
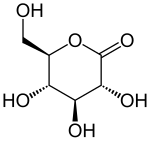 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | D-glukono-1,5-lakton |
| Ostatní názvy | glukonodeltalakton |
| Sumární vzorec | C6H10O6 |
| Vzhled | bílý krystalický prášek[1] |
| Identifikace | |
| Registrační číslo CAS | 90-80-2 |
| EC-no (EINECS/ELINCS/NLP) | 202-016-5 |
| PubChem | 736 |
| ChEBI | 16217 |
| SMILES | C([C@@H]1[C@H]([C@@H]([C@H](C(=O)O1)O)O)O)O |
| InChI | InChI=1S/C6H10O6/c7-1-2-3(8)4(9)5(10)6(11)12-2/h2-5,7-10H,1H2/t2-,3-,4+,5-/m1/s1 |
| Vlastnosti | |
| Molární hmotnost | 178,14 g/mol |
| Teplota tání | 150 až 153 °C (423 až 426 K) |
| Rozpustnost ve vodě | rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu[1] |
Některá data mohou pocházet z datové položky. | |
Glukonolakton (přesněji glukonodeltalakton, zkráceně GDL) je organická sloučenina, lakton odvozený od kyseliny glukonové. Používá se v potravinářství pod označením E 575[2] jako sekvestrant a regulátor kyselosti.[3]
Použití glukonolaktonu v potravinářství je velmi rozmanité, najdeme ho v mléčných i masných výrobcích, pečivu, tofu, alkoholických i nealkoholických nápojích. Mezi jeho výhody patří skutečnost, že zabraňuje množení bakterií, vzniku zákalu a stabilizuje barvu produktu. Přidává se ale také do kosmetických prostředků, včetně deodorantů, šamponů či zubních past.[4]
GDL se může přidávat do sýru feta.[5] Klukonolakton je pH neutrální, ovšem ve vodě podléhá hydrolýze na kyselinu glukonovou, která vytváří kyselé prostředí; je však zhruba třikrát méně kyselá než kyselina citronová. Metabolizuje se na 6-fosfo-D-glukonát, přičemž se uvolní podobné množství energie jako ze stejného množství cukru.
Za přítomnbosti vody se glukonolakton částečně hydrolyzuje na kyselinu glukonovou, přičemž se tvoří chemická rovnováha mezi kyselinou a laktonem. Rovnovážná konstanta této hydrolýzy se zvyšuje s rostoucí teplotou a nárůstem pH.[6]
Kvasinky Saccharomyces bulderi mohou přeměnit glukonolakton na ethanol a oxid uhličitý. Jejich růst silně závisí na pH. Glukonolakton v hmotnostním podílu 1 až 2 % v minerálních roztocích způsobí pokles pH pod 3.[7] Tato látka při koncentracích okolo 0,001 mol/l také působí jako inhibitor enzymu amygdalin beta-glukosidázy.[8]
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Glukono-delta-lakton na Wikimedia Commons
Obrázky, zvuky či videa k tématu Glukono-delta-lakton na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Glucono delta-lactone na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/736
- ↑ Current EU approved additives and their E Numbers, Food Standards Agency
- ↑ F. Martin; N. Cayot; A. Marin; L. Journaux; P. Cayot; P. Gervais; R. Cachon. Effect of oxidoreduction potential and of gas bubbling on rheological properties and microstructure of acid skim milk gels acidified with glucono-δ-lactone. Journal of Dairy Science. 2009, s. 5898–5906. Dostupné online. DOI 10.3168/jds.2009-2491. PMID 19923593.
- ↑ Co je E575 - Glukonolakton?. AZ-recepty.cz [online]. [cit. 2023-09-14]. Dostupné online.
- ↑ Joanna Blythman. Inside the food industry: the surprising truth about what you eat [online]. The Guardian, 2015-02-21 [cit. 2016-10-28]. Dostupné v archivu pořízeném z originálu dne 2016-08-13.
- ↑ Y. Pocker; Edmond Green. Hydrolysis of D-Glucono-δ-lactone. I. General Acid–Base Catalysis, Solvent Deuterium Isotope Effects, and Transition State Characterization. Journal of the American Chemical Society. 1973, s. 113–119. DOI 10.1021/ja00782a019. PMID 4682891.
- ↑ J. P. Van Dijken; A. Van Tuijl; M. A. Luttik; W. J. Middelhoven; J. T. Pronk. Novel pathway for alcoholic fermentation of delta-gluconolactone in the yeast Saccharomyces bulderi. Journal of Bacteriology. 2002, s. 672–678. DOI 10.1128/JB.184.3.672-678.2002. PMID 11790736.
- ↑ M. Petruccioli; L. Brimer; A. R. Cicalini; F. Federici. Production and Properties of the Linamarase and Amygdalase Activities of Penicillium aurantiogriseum P35. Bioscience, Biotechnology, and Biochemistry. 1999, s. 805–812. DOI 10.1271/bbb.63.805. PMID 10380623.
