Halogen
 | |
| Substància química | grup de la taula periòdica i grup dels elements representatius |
|---|---|
| Nom curt | X |
| Descobridor o inventor | Jöns Jacob Berzelius |
Els halògens són els elements del grup 17 de la taula periòdica i que tenen configuració electrònica ns² np⁵, i són: fluor (F), clor (Cl), brom (Br), iode (I), àstat (At) i tennes (Ts). El mot "halogen" vol dir "que forma sals", compost de les formes gregues ἅλς, halo-, 'sal', i de γένος, génos, 'naixement, raça', que significa 'que genera', que produeix'.[1]
En la natura, es troben en forma de molècules diatòmiques i en diferents estats: gas (F₂, Cl₂), líquid (Br₂) o sòlid (I₂). Aquests són elements volàtils, que tendeixen a capturar un electró per acabar d'emplenar la seva capa de valència, formant un anió (halur). També tendeixen a reaccionar amb metalls alcalins i alcalinoterris per formar sals iòniques. En augmentar el nombre atòmic s'intensifica el color (el fluor és groc pàl·lid, el clor verd, el brom vermell i el iode violat). El clor és el més conegut dels elements halògens. L'element lliure s’utilitza àmpliament com a agent de purificació d’aigua i s’utilitza en diversos processos químics. La sal de taula, el clorur de sodi, és un dels compostos químics més familiars. Els fluorurs són coneguts principalment per la seva addició a subministraments públics d’aigua per evitar la càries, però els fluorurs orgànics també s’utilitzen com a refrigerants i lubricants. El iode és més conegut com a antisèptic i el brom s’utilitza principalment per preparar compostos de brom que s’utilitzen en ignífugs i com a pesticides generals.
Història
[modifica]El clor fou el primer halogen en ser descobert. Els alquimistes coneixien l'àcid clorhídric, la dissolució aquosa de clorur d'hidrogen , però el clor no fou produït fins al 1774 per Carl Wilhelm Scheele (1742-1786) a Uppsala, Suècia, escalfant l’àcid clorhídric amb el mineral pirolusita que té diòxid de manganès natural, . Obtingué un gas dens i de color groc verdós que tenia amb una olor sufocant i que es dissolgué en aigua per donar una solució àcida. Observà que blanquejava paper de tornassol i descoloria fulles i flors. Humphry Davy l'investigà el 1807 i finalment conclogué no només que era una substància simple, sinó que era realment un element. Ho anuncià el 1810 i, tot i això, passaren deu anys més perquè alguns químics finalment acceptessin que el clor era realment un element.[2] El mot «clor» prové del grec χλωρóς, khlōrós, 'verd clar' pel seu color.[3]
A principis del 1800, Bernard Courtois (1777-1838) de París produïa nitre (nitrat de potassi, ) a partir de les cendres de les algues. Un dia de 1811, afegí àcid sulfúric i observà fums de color porpra que es condensaven per formar cristalls amb una brillantor metàl·lica. Courtois suposà que aquest era un element nou i donà algunes mostres a Charles-Bernard Desormes (1777-1862) i a Nicolas Clément (1779-1841), que realitzaren una investigació sistemàtica i confirmaren el descobriment. El novembre de 1813 exposaren iode a l’Institut Imperial de París.[2] Joseph-Louis Gay-Lussac demostrà que realment era nou i l'anomenà iode del grec ἰώδης, iṓdēs, 'violat, marró', de íon 'violeta' i eĩdos 'aspecte'.[4][5] Humphry Davy, que visitava París, envià un informe a la Royal Institution de Londres on suposaren per error que ell era el descobridor, una creença que persistí durant més de 50 anys.[2]
El químic francès Antoine-Jérôme Balard (1802-1876) descobrí el brom mentre investigava l’aigua salada de Montpeller, França. Prengué el residu concentrat que quedava després que la major part de la salmorra s'havia evaporat i hi passés clor gasós. En fer-ho, alliberà un líquid vermell taronja que deduí que era un element nou. El 1826 envià una memòria de les seves troballes a la revista de l'Académie des Sciences.[2] El nom prové del grec βρῶμος, brõmos, 'pudor',[6][7] nom proposat per l'Académie de Sciences.[2]
Els primers químics eren conscients que els fluorurs metàl·lics contenien un element no identificat similar al clor, però no el podien aïllar. El científic francès André Marie Ampère (1773-1835) encunyà el nom de «fluor» el 1812[2]a partir del llatí fluor, -ōris 'raig, acte de rajar',[8] perquè el mineral més comú, la fluorita, constituït per fluorur de calci, flueix en fondre's. L'anglès Humphry Davy (1778-1829) no pogué produir l'element i s'emmalaltí intentant aïllar-lo de l'àcid fluorhídric. El químic britànic George Gore (1826-1908) el 1869 passà un corrent elèctric per fluorur d'hidrogen líquid, i observà que el gas alliberat reaccionava violentament amb el seu aparell. Pensà que era fluor però no pogué recollir-lo i demostrar-ho. Després, el 1886, el químic francès Henri Moissan (1852-1907) aconseguí obtenir-lo mitjançant l'electròlisi del hidrogenfluorur de potassi dissolt en fluorur d'hidrogen líquid.[2] El 1940 Dale R. Corson (1914-2012), Kenneth R. MacKenzie (1912-2002) i Emilio Segrè (1905-1989) de la Universitat de Califòrnia a Berkeley sintetitzaren sense ambigüitat l'element 85 per bombardeig d'àtoms de bismut 209 amb partícules alfa mitjançant la reacció en un ciclotró:[9][10]El 1943 la física austríaca Berta Karlik (1904-1990), amb la seva assistent Traude Bernert, detectaren tres isòtops de l’àstat de nombres màssics 215, 216 i 218 a les cadenes de desintegració naturals,[11] essent la primera detecció confirmada de l'àstat a la naturalesa.[12] El 1947, acabada la Segona Guerra Mundial que aturà les seves investigacions, l'equip de Segrè proposà donar al nou element el nom d'«àstat», del grec ἄστατον, ástaton, 'inestable'.[13][10]
El tennes fou obtingut per científics del Joint Institute for Nuclear Research de Dubnà, Rússia, del Lawrence Livermore National Laboratory de Califòrnia, EUA i del Oak Ridge National Laboratory de Tennessee, EUA) el 2015.[14]
Estat natural
[modifica]
A causa de la seva gran reactivitat, els quatre primers halògens no es troben lliures a la natura. L'àstat és inestable i els seus isòtops només tenen unes poques hores de vida, per la qual cosa no s'acumula. El tennes és sintètic i altament inestable, només s'observen uns pocs àtoms en el moment de sintetitzar-los. En forma combinada, el fluor és el més abundant dels halògens a l'escorça terrestre amb 950 ppm (950 mg/kg), seguit del clor amb 130 ppm, del brom 0,4 ppm i del iode 0,14 ppm. El fluor és ocupa la posició 13a en abundància, el clor la 20a, el brom la 62a i el iode la 64a. En els sòls al fluor hom el troba en concentracions entre 150 ppm i 400 ppm, el clor entre 50 ppm i 2 000 ppm, el brom entre 5 ppm i 40 ppm, i el iode entre 0,1 ppm i 10 ppm.[15]
A l'aigua de la mar el més abundant és el clor, ja que forma part del clorur de sodi o sal comuna. Hom troba a l'aigua de la mar una mitjana d'un 1,8 % de clor, 65 ppm (65 mg/L) de brom, 13 ppm de fluor i 0,06 ppm de iode. A l'atmosfera la concentració de fluor és de 0,6 ppb (0,6 nL/L) majoritàriament formant part del clorofluorocarbonis, de clor i brom només se'n detecten quantitats insignificants i de iode entre 0,2 i 60 ppb (a l'aigua de pluja en conté de iode 0,7 ppb (0,7 μg/L).[15]
Propietats
[modifica]| Halogen | Molècula | Estructura | Model
molecular |
d(X−X) gas
(pm) |
d(X−X) sòlid
(pm) |
Punt de
fusió (°C)[16] |
Punt
d'ebullició (°C)[16] |
|---|---|---|---|---|---|---|---|
| fluor | F₂ | 143 | 149 | –219,67 | –188,11 | ||
| clor | Cl₂ | 199 | 198 | –101,5 | –34,04 | ||
| brom | Br₂ | 
|
228 | 227 | –7,2 | –58,8 | |
| iode | I₂ | 
|
266 | 272 | 113,7 | 184,4 |
Propietat físiques
[modifica]El fluor és un gas de color groguenc pàl·lid, lleugerament més pesant que l'aire, corrosiu i d'olor penetrant i irritant. El clor és un gas groguenc verdós d'olor penetrant i irritant. El brom a temperatura ambient és un líquid de color roig obscur, tres vegades més dens que l'aigua, que volatilitza amb facilitat produint un vapor verinós. Amb el mercuri són els únics elements líquids a temperatura ambient (20 °C). El iode és un sòlid cristal·lí a temperatura ambient, color negre brillant, que sublima donant un vapor violeta molt intens, verinós i d'olor picant.[16]
A temperatura ambient i pressió atmosfèrica, els halògens en els seus estats lliures existeixen com a molècules diatòmiques . En el fluor molecular F₂ els àtoms es mantenen units per un enllaç covalent fet a partir de la unió d’un orbital p de cada àtom, classificant-se com un enllaç sigma σ. Cal esmentar que l'energia de dissociació del fluor (l'energia necessària per trencar l'enllaç F—F) és més d’un 30 % menor que la del clor, però és similar a la del iode I₂. La debilitat de l'enllaç F—F en comparació amb el Cl—Cl es pot atribuir a la petita mida del fluor, cosa que provoca una disminució de la superposició d’orbitals enllaçants i una major repulsió dels orbitals no enllaçants. En el iode, però, els orbitals p són més difusos, la qual cosa significa que l'enllaç es fa més feble que en el clor o en el brom.
Propietats químiques
[modifica]Els àtoms dels halògens tenen set electrons de valència, configuració electrònica ns² np⁵. Potencialment, un àtom d’halogen podria contenir un electró més (en un orbital p), cosa que donaria a l’anió halogen resultant la mateixa configuració electrònica que la del gas noble que té a la dreta a la taula periòdica. Les configuracions electròniques amb capes completes són excepcionalment estables. Aquesta acusada tendència dels halògens a adquirir un electró addicional els converteix en forts oxidants. Les afinitats electròniques (energia que es desprèn en adquirir un electró) en eV són: 3,40 pel F, 3,61 pel Cl, 3,36 pel Br, 3,06 pel I i 2,8 per l'At; essent les més altes, amb diferència, dels totes les dels elements químics. El potencials de reducció estàndards dels elements són: ε(F₂/F–) = 2,87 V; ε(Cl₂/Cl–) = 1,358 V; ε(Br₂/Br–) = 1,087 V; ε(I₂/I–) = 0,53 V .[16]
Estats d'oxidació 0 i -1
[modifica]
Els elements halògens mostren grans semblances entre si en el seu comportament químic general i en les propietats dels seus compostos amb altres elements. No obstant això, hi ha un canvi progressiu en les propietats des del fluor fins a l'àstat, essent la diferència entre dos elements successius més pronunciada del fluor al clor. El fluor és el més reactiu dels halògens i, de fet, de tots els elements, i té certes altres propietats que el diferencien dels altres halògens. La seva gran reactivitat prové en gran manera de l'energia de dissociació relativament baixa de l'enllaç F—F (37,7 kcal/mol) i la seva capacitat de formar enllaços forts estables amb, essencialment, tots els altres elements. Totes les afinitats electròniques dels àtoms halògens són elevades i només mostren lleugeres diferències entre si. Tanmateix, se sap que les propietats oxidants (capacitat d’acollir un electró mitjançant la formació d’un enllaç amb un altre àtom) augmenten de l’àstat al fluor. Aquest augment hom pot atribuir-la a la baixa energia de dissociació i a l'alta afinitat electrònica del fluor combinada amb la força de l'enllaç fluor-heteroàtom resultant, que resulta en una gran calor de reacció. Tot i que l’ió fluor no presenta propietats reductores, l’ió iodur és un agent reductor suau. El fluor té la electronegativitat més alta de tots els elements (χF = 3,98 en l'escala de Pauling) i hi ha una disminució de la electronegativitat dins de la família dels elements halògens, des del fluor fins al clor, el brom i el iode fins a l’àstat (χF = 3,98, χCl = 3,16, χBr = 2,96, χBr = 2,66 i χAt = 2,2). El fluor substitueix qualsevol altre ió halogen dels seus compostos.[17]
Probablement la generalització més important que es pot fer sobre els elements halògens és que tots són agents oxidants; és a dir, augmenten l'estat d’oxidació, o nombre d’oxidació, d’altres elements, que s’interpreta en termes de transferència d’electrons d’un àtom a un altre. En oxidar un altre element, l'halogen es redueix; és a dir, el seu nombre d’oxidació 0 passa a –1. Els halògens es poden combinar amb altres elements per formar compostos coneguts com halurs: fluorurs, clorurs, bromurs, iodurs i àstaturs. La tendència dels elements halògens a formar compostos altament iònics augmenta en el següent ordre: àstat < iode < brom < clor < fluor. Els fluorurs solen ser més estables que els clorurs, bromurs o iodurs corresponents. La força oxidant dels halògens augmenta en el mateix ordre, és a dir, de l’àstat al fluor. Per tant, dels elements halògens, el fluor elemental es prepara amb major dificultat i el iode amb menys. Com a classe, els elements halògens són no metàl·lics, però l’àstat presenta certes propietats semblants a les dels metalls.[17]
Es pot considerar que molts dels halurs són sals dels respectius halurs d’hidrogen, que són gasos incolors a temperatura ambient i pressió atmosfèrica i (excepte el fluorur d’hidrogen) formen àcids forts en solució aquosa. De fet, el terme general sal es deriva de sal de roca, o sal de taula (clorur de sodi). L'energia de l'enllaç hidrogen-halogen augmenta fortament del iodur al fluor. El fluorur d’hidrogen en estat cristal·lí consisteix en infinites cadenes en ziga-zaga, tal com es mostra al diagrama,


Les línies sòlides representen enllaços covalents entre els àtoms d’hidrogen i fluor dins de les molècules i les línies de punts representen enllaços per pont d’hidrogen. Els enllaços per pont d’hidrogen entre les molècules de fluorur d’hidrogen són considerablement més febles (7 kcal/mol) que els covalents (135 kcal/mol), tot i que es mantenen en gran manera en estat líquid. En els altres halurs d’hidrogen no tenen enllaços per pont d’hidrogen sinó forces de Van der Waals, considerablement més febles. La gran diferència en l'enllaç per pont d’hidrogen entre el fluorur d’hidrogen i els altres halurs d’hidrogen explica els punts de fusió i ebullició relativament elevats del fluorur d’hidrogen en comparació amb els del clorur d’hidrogen i els altres halurs d’hidrogen. Les energies d'enllaç hidrogen-halogen també disminueixen considerablement en passar del fluorur d'hidrogen al iodur d'hidrogen.
Estats d'oxidació positius
[modifica]Les energies d’ionització dels halògens són generalment elevades, però cauen notablement amb l’augment del nombre atòmic. El fluor és l’únic halogen que no forma compostos amb estats d’oxidació positius, és a dir, estats en què ha perdut, en lloc d’haver guanyat, electrons. Aquesta propietat està relacionada amb el fet que el fluor tingui l'electronegativitat més alta de tots els elements, χF = 3,98 en l'escala de Pauling; és a dir, no cedeix els seus electrons a altres elements.
Tots els halògens posseeixen l'estat d’oxidació 0 en les seves formes diatòmiques. El fluor presenta els estats d’oxidació de −1 (ió F−) i +1 (àcid hipofluor). Els principals estats d’oxidació del clor, el brom i el iode són −1, +1, +3, +5 i +7. Els oxàcids són compostos en què els àtoms d’halogen s’uneixen als àtoms d’oxigen. Són agents oxidants de gran abast, que es poden reduir als halurs d’hidrogen corresponents; el nombre d’oxidacions canvia de positiu a -1 en el procés. La força oxidant dels oxianions augmenta amb l’augment del nombre d’oxidació de l’àtom d’halogen.
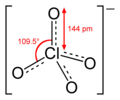
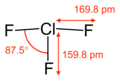
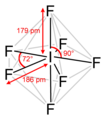
Totes les molècules i ions en què els àtoms d’halogen tenen quatre parells d’electrons de valència són tetraèdrics, com, per exemple, en l’ió perclorat . Els que fan servir cinc parells d'electrons de valència, com el trifluorur de clor , tenen estructures derivades d'una disposició bipiramidal trigonal de parells d'electrons. Tanmateix, atès que els parells solitaris d’electrons (és a dir, els parells d’electrons que no uneixen els àtoms) no es localitzen mitjançant tècniques que analitzen l'estructura, només es veuen les posicions dels àtoms de fluor (units als parells d’unió). Per tant, té una forma de T resultant de la col·locació d’àtoms de fluor tant en la posició axial com en una posició equatorial de la bipiràmide trigonal, amb parells d’electrons solitaris a les dues posicions equatorials restants. Les molècules amb sis parells d’electrons de valència tenen estructures derivades de la geometria octaèdrica per als parells d’electrons; per exemple, el pentafluorur de iode té una estructura piramidal quadrada resultant de l'enllaç dels àtoms de fluor per cinc dels sis parells d’electrons octaèdrics. L’heptafluorur de iode té una disposició bipiramidal pentagonal d’àtoms de fluor.
-
Anió perclorat
-
Trifluorur de clor
-
Pentafluorur de iode
-
Pentafluorur de iode
El nombre més alt de coordinació observat (el nombre d’àtoms que un àtom central té com a veïns en un compost) de clor (estat d’oxidació de +7) cap a l’oxigen és 4 (és a dir, l’àtom de clor està envoltat per quatre àtoms d’oxigen), com que es troba en l’ió perclorat, (ClO4) -, mentre que el del iode (+7) és 6, com en l’ió paraperiodat, (IO6) 5−. Cap al fluor, les xifres màximes de coordinació són més altes. Per exemple, el clor pot coordinar-se a sis àtoms de fluor, com a (ClF6) +, i el iode (+7) a vuit àtoms de fluor, com a (IF8) -.
Aplicacions
[modifica]Fluor
[modifica]
La fluorita (fluorur de calci) s'utilitza com a fundent metal·lúrgic en la fosa de l'alumini i de l'acer, atès que fa més manejables i més reactives les escòries, la qual cosa facilita l'eliminació d'impureses i permet aconseguir un millor rendiment en el procés de fusió. També s'utilitza en la producció de compostos organofluorats, com el polímer tefló (PTFE), que s'empra en revestiments d'avions, coets, cables, condensadors, paelles, etc. ja que és un gran aïllant amb molta resistència a les temperatures altes. El tefló també és usat en la fabricació de pròtesis mèdiques, ja que no reacciona amb cap substància ni teixit, i també forma part del Gore-Tex, un teixit que protegeix dels efectes de l'aire, l'aigua i el vent amb una eficient transpirabilitat. L'àcid fluorhídric és l'únic àcid que dissol el vidre, cosa per la qual s'utilitza per a fer-hi gravats o per a convertir-lo en vidre glaçat. Aquest àcid també s'utilitza en la producció de fàrmacs antidepressius com la fluoxetina (Prozac). La fluorodesoxiglucosa amb l'isòtop radioactiu fluor 18 és un radiofàrmac usat en l'obtenció d'imatges mèdiques mitjançant tomografia per emissió de positrons (PET) mitjançant les quals es pot avaluar el metabolisme de la glucosa en el cor, els pulmons i el cervell. L'hexafluorur d'urani s'utilitza en el procés d'enriquiment de l'urani natural per a produir el combustible urani 235, utilitzat en la generació de corrent elèctric als reactors nuclears.[18]
Clor
[modifica]
El clor s'usa principalment en la potabilització i purificació de l'aigua. L'hipoclorit de sodi (lleixiu) s'utilitza per a blanquejar la pasta de cel·lulosa en la fabricació de paper, i en el blanqueig de teixits. També s'utilitza com a desinfectant. L'àcid clorhídric, la dissolució de clorur d'hidrogen en aigua, té moltes aplicacions industrials; també s'empra com a producte de neteja (conegut com salfumant). El clor s'utilitza en la producció de clorur de vinil, compost emprat en la fabricació de clorur de polivinil o PVC. També s'usa en la producció de diferents compostos, com el tetraclorur de carboni i el cloroform .[18]
Brom
[modifica]El brom s'utilitza, en forma de tetrabromobisfenol, com a retardador de flama. Aquest compost retardant s'afegeix en la fabricació de polièsters i resines epòxiques utilitzades en targetes de circuits impresos. El bromometà s'utilitza com a plaguicida per a la fumigació del sòl. El brom s'utilitza en la producció d'olis vegetals bromats (BVO), que es fan servir com a emulsionants en moltes begudes cítriques sense alcohol. La quantitat d'aquest additiu alimentari en les begudes refrescants està regulada, ja que un excés d'ingesta pot ser perjudicial per a la salut.[18]
Iode
[modifica]
El iode s'utilitza com a catalitzador en la producció d'àcid acètic i com a desinfectant en el tractament de l'aigua. També com a biocida en pintures, adhesius i tractaments de la fusta. La povidona iodada (polímer combinat amb iode) és el component bàsic de molts antisèptics i desinfectants que s'utilitzen per a tractar talls a la pell i petites ferides. S'utilitza com a element de contrast en les radiografies amb raigs X de certes parts del cos, ja que el iode és un element pesant i és opac als raigs gamma. El iode 131, radioactiu, s'utilitza en la teràpia per a tractar l'hipertiroïdisme. El iode 125 s’utilitza en braquiteràpia per al tractament de tumors de pròstata i el iode 123 per al diagnòstic de la malaltia de Parkinson. El iode forma de part d'alguns tipus de bombetes halògenes. La sal iodada (clorur de sodi amb una petita quantitat de iodur de potassi , de iodat de sodi o de iodat de potassi ) es fa servir per a corregir deficiències d'aquest element en el cos humà. El iodur d'argent és l'element base de les pel·lícules fotogràfiques. El iode és un component clau de les làmines polaritzants de pantalles (LCD/LED) de mòbils, tauletes i televisors.[18]
Referències
[modifica]- ↑ Alcover-Moll. «halogen». Diccionari català-valencià-balear. Editorial Moll. [Consulta: 5 febrer 2016].
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Emsley, John. Nature's building blocks: an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ «Clor». Gran Diccionari de la Llengua Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ «Iode». Gran Diccionari de la Llengua Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Alcover, Antoni M.; Moll, Francesc de B. «Iode». A: Diccionari català-valencià-balear. Palma: Moll, 1930-1962. ISBN 8427300255.
- ↑ «Brom». Gran Diccionari de la Llengua Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Alcover, Antoni M.; Moll, Francesc de B. «Brom». A: Diccionari català-valencià-balear. Palma: Moll, 1930-1962. ISBN 8427300255.
- ↑ «Fluor». Gran Diccionari de la Llengua Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Corson, D. R.; MacKenzie, K. R.; Segrè, E. «Artificially Radioactive Element 85». Physical Review, 58, 8, 15-10-1940, pàg. 672–678. DOI: 10.1103/PhysRev.58.672.
- ↑ 10,0 10,1 John., Emsley,. Nature's building blocks: an A-Z guide to the elements. Oxford University Press, 2011. ISBN 978-0-19-960563-7.
- ↑ Karlik, Berta; Bernert, Traude «Über eine vermutete ß-Strahlung des Radium A und die natürliche Existenz des Elementes 85» (en alemany). Naturwissenschaften, 30, 44, 01-10-1942, pàg. 685–686. DOI: 10.1007/BF01487965. ISSN: 1432-1904.
- ↑ Forstner, Christian. Berta Karlik and Traude Bernert: The Natural Occurring Astatine Isotopes 215, 216, and 218. WORLD SCIENTIFIC, 2019-05-07, p. 350–357. DOI 10.1142/9789811206290_0027. ISBN 978-981-12-0628-3.
- ↑ Corson, D. R.; Mackenzie, K. R.; Segrè, E. «Astatine : The Element of Atomic Number 85» (en anglès). Nature, 159, 4027, 1-1947, pàg. 24–24. DOI: 10.1038/159024b0. ISSN: 1476-4687.
- ↑ «Tennessine - Element information, properties and uses | Periodic Table». [Consulta: 6 setembre 2021].
- ↑ 15,0 15,1 Emsley, John. Nature's Building Blocks: an a-Z Guide to the Elements.. 2a edició. Oxford: Oxford University Press, Incorporated, 2011. ISBN 978-0-19-257046-8.
- ↑ 16,0 16,1 16,2 16,3 M., Haynes, William. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data.. 93. Boca Raton: CRC Press, 2012. ISBN 978-1-4398-8049-4.
- ↑ 17,0 17,1 Christe, Karl; Schneider, Stefan i Gutmann, Viktor. «Halogen». Encyclopedia Britannica, 23-10-2020. [Consulta: 4 setembre 2021].
- ↑ 18,0 18,1 18,2 18,3 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. 3a. Iniciativa Digital Politècnica, 2017. ISBN 978-84-9880-666-3.