Hidróxido de aluminio
| Hidróxido de aluminio | ||
|---|---|---|
 Modelo de barras y esferas de hidróxido de aluminio | ||
 Muestra de hidróxido de aluminio en un vial | ||
| Nombre IUPAC | ||
| Trihidróxido de aluminio | ||
| General | ||
| Otros nombres |
Hidróxido de aluminio Hidróxido alumínico Hidróxido de aluminio(III) | |
| Fórmula estructural |
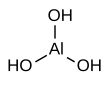 | |
| Fórmula molecular | ||
| Identificadores | ||
| Código ATC | A02AB01 | |
| Número CAS | 21645-51-2[1] | |
| Número RTECS | BD0940000 | |
| ChEBI | 33130 | |
| ChEMBL | CHEMBL1200706 | |
| ChemSpider | 8351587 | |
| DrugBank | 06723 | |
| PubChem | 10176082 | |
| UNII | 5QB0T2IUN0 | |
| KEGG | D02416 | |
|
[OH-].[OH-].[OH-].[Al+3]
| ||
| Propiedades físicas | ||
| Apariencia | polvo amorfo blanco | |
| Densidad | 2420 kg/m³; 2,42 g/cm³ | |
| Masa molar | 78,03 g/mol | |
| Punto de fusión | 573 K (300 °C) | |
| Estructura cristalina | Octaedral | |
| Índice de refracción (nD) | 1,57[2] | |
| Constante dieléctrica | 2,2[3] | |
| Propiedades químicas | ||
| Acidez | >7 pKa | |
| Solubilidad en agua | 0,0001 g/100 mL | |
| Solubilidad | soluble en ácidos y bases | |
| Producto de solubilidad | 3×10−34 | |
| Propiedades farmacológicas | ||
| Categoría embarazo | B[4] | |
| Termoquímica | ||
| ΔfH0sólido | -1277 kJ/mol | |
| Peligrosidad | ||
| NFPA 704 |
0
1
0
| |
| Frases H | H 319, H 335 | |
| Frases P | P 264, P 261, P 280, P 271, P 312, P 304+340, P 305+351+338, P 337+313 | |
| Riesgos | ||
| LD50 | >5000 mg/kg (ratas, oral) | |
| Más información | FDS (en inglés) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El hidróxido de aluminio, Al(OH)3, es la forma más estable del aluminio en condiciones normales. En la naturaleza se encuentra como mineral de gibbsita. Están cercanamente relacionados el hidróxido de óxido de aluminio, AlO(OH), y el óxido de aluminio, Al2O3, diferenciándose únicamente por la pérdida de agua. Juntos, estos compuestos son los componentes principales del mineral o mena de aluminio, la bauxita.
Tiene varios usos, como un agente extintor en los plásticos, y en la medicina, como un antiácido, quelante de fosfato y adyuvante en las vacunas.
Nomenclatura
[editar]La nomenclatura de las diferentes formas de hidróxido alumínico es ambigua, y no existe un estándar universal. Hay cuatro polimorfos, cada uno con un átomo de aluminio ligado a tres grupos hidróxidos.[5]
La gibbsita también se conoce como hidrargilita, de las palabras griegos para agua (hydra) y arcilla (argylles). El primer compuesto llamado hidragilita se considera ser hidróxido de aluminio, pero se descubrió que era en realidad fosfato de aluminio. Sin embargo, se usa tanto gibbsita como hidragilita para referir al mismo politipos de hidróxido de aluminio, con gibbsita usado más en los EE. UU. e hidragilita usado más en Europa. En 1930, se refirió a α-trihidrato de aluminio para diferirse de bayerita, que se refirió a β-trihidrato de aluminio—el α y β signaron las formas más y menos usados respectivamente—. En 1957, un simposio de la nomenclatura de alúmina trató de desarrollar un estándar universal, y resultó que gibbsita fue designado γ-Al(OH)3, bayerita fue designado α-Al(OH)3 y nordstrandita fue designado Al(OH)3. Otra nomenclatura sugerida, que se basó en las propiedades cristalográficas, designó la gibbsita α-Al(OH)3, la bayerita β-Al(OH)3, y ambos la nordstrandita y doyleíta Al(OH)3. Con este sistema, el prefijo α se refiere a las estructuras hexagonal y compacto, y el β se refiere a ellas alteradas y deshidratadas; no hay diferencia entre nordstandita y doyleita.[5][6][7]
Propiedades
[editar]Gibbsita tiene una estructura típica de los hidróxidos metálicos con enlaces de hidrógeno. Tiene dos niveles de grupos hidróxidos con iones de aluminio ocupando dos tercios de los agujeros octaédricos entre los dos niveles.[8][9]
El hidróxido de aluminio es anfotérico. En ácidos, actúa como un base de Brønsted-Lowry por recoger iones de hidrógeno y neutralizar el ácido, los cuales producen un sal:[10]
- 3HCl + Al(OH)3 → AlCl3 + 3H2O
En bases, actúa como un ácido de Lewis por tomar un par de electrones de los aniones hidróxido:[10]
- Al(OH)3 + OH– → Al(OH)4–
Polimorfismo
[editar]Existen cuatro polimorfos del hidróxido de aluminio: gibbsita, bayerita, nordstrandita y doyleita. Todos se basan en la combinación común de un átomo de aluminio y tres grupos hidroxilos en diferentes disposiciones de cristal que determinan la apariencia y los propiedades del compuesto. Cada uno tiene niveles de hidróxidos de aluminio en forma de octaedro, y enlaces de hidrógeno que ligan los niveles. Los polimorfos se diferencian en como los niveles se juntan, lo que es afectado por la acidez, la presencia de iones (incluyendo sal) y la superficie sobre que la sustancia se forma. En la mayoría de condiciones, la gibbsita es la forma más estable de hidróxido de aluminio.[5]
Producción
[editar]Casi todo el hidróxido de aluminio comercial se manufactura por el proceso Bayer, en el que se disuelve bauxita en hidróxido de sodio en temperaturas hasta 270 °C. Se quita el sólido residual, relave de bauxita—que es, más que nada, óxido de hierro—, y se precipita el hidróxido de aluminio de la solución restante. Se puede convertir este producto a alúmina por la calcinación.[11]
El residuo es también muy corrosivo por tener hidróxido de sodio. Se depositaban históricamente en lagunas, que llevó al accidente de la fábrica de alúmina de Ajka, Hungría, en 2010, cuando una presa estalló y nueve personas se ahogaron. Además 122 personas sufrieron quemaduras químicas. El barro contaminó 40 km² de tierra y se llevó al Danubio. Aunque el barro se consideró no tóxico por tener bajos niveles de metal pesado, tenía un pH de 13.[12]
Usos
[editar]Uno de los usos primarios del hidróxido de aluminio como materia prima es para fabricar otros compuestos con aluminio, incluyendo la alúmina calcinada, el sulfato de aluminio, el hidroxicloruro de aluminio, el cloruro de aluminio, la zeolita, el aluminato de sodio, la alúmina activada y nitrato de aluminio.[9]
Agente extintor
[editar]El hidróxido de aluminio también se utiliza como relleno ignífugo en polímeros de forma similar al hidróxido de magnesio y las mezclas de huntita e hidromagnesita.[13][14][15][16][17] Se descompone a unos 180 °C, absorbiendo una cantidad considerable de calor en el proceso y desprendiendo vapor de agua. Además de comportarse como una resistencia al fuego, es muy eficaz como un supresor de humo en varios polímeros, especialmente en el poliéster, el acrílico, el etileno, el acetato de vinilo, la resina epoxica, el PVC y el caucho.[18]
Farmacéutica
[editar]Con el nombre genérico 'algedrate', se usa el hidróxido de aluminio como un antiácido en personas y animales (por primer parte los gatos y perros). Se prefiere a alternativos como bicarbonato de sodio por ser insoluble—así, no aumenta el pH del estómago más de 7, que causaría la secreción de ácido excesivo—. Mejor, neutraliza el ácido excesivo y baja el pH,[19][20] que puede aliviar los síntomas de la úlcera péptica, el pirosis y la dispepsia. A diferencia de otros antiácidos, el hidróxido de aluminio no produce gases de CO2, no causa eructos y, por la efectividad de la reacción de neutralización, no es frecuente la aparición de una alcalosis metabólica.[21] Sin embargo, las sales de aluminio pueden producir estreñimiento porque los iones alumínicos inhiben las contracciones de las células del tracto gastrointestinal, que desacelera el peristalsis y extiende el tiempo necesario para las heces a pasar a través el intestino grueso. Hay productos como Maalox que son formulados para minimizar estos efectos por incluir concentraciones iguales del hidróxido de magnesio o carbonato de magnesio, que tienen efectos contrapesos.[22]
El hidróxido de aluminio también se usa como un quelante de fosfato para controlar la hiperfosfatemia—niveles elevados del fosfato en el sangre—en personas y animales con el fallo renal. Normalmente, los riñones filtran el fosfato excesivo de la sangre, pero el fallo renal puede causar la acumulación del fosfato. La sal aluminio, cuando se ingesta, liga al fosfato en las intestinas y baja la cantidad de fosfato que puede ser absorbido.[23][24]
Cuando es precipitado, el hidróxido de aluminio se incluye como adyuvante en unas vacunas (por ejemplo, la vacuna contra el carbunco). Porque absorbe las proteínas muy bien, también funciona para estabilizar las vacunas por prevenir las proteínas de precipitar o adherir de las paredes del vial durante el almacenamiento. Vacunas con hidróxido de aluminio estimulan el sistema inmunitario por inducir la liberación de ácido úrico, que hace señas del peligro. Este atrae ciertos tipos de monocitos, que se diferencian a células dendríticas. Estas células recogen el antígeno y lo traen a los ganglios linfáticos, donde estimulan los linfocitos T y B.[25] Aparece contribuir a una respuesta buena de los linfocitos Th2, y por eso es útil para inmunizar contra las patogenias que los anticuerpos bloquean. Sin embargo, tiene menos capacidad de estimular una respuesta de los infocitos Th1, que son importante para proteer a muchas patogenias,[26] y tampoco es útil cuando el antígeno se basa en péptidos.[27]
Efectos adversos potenciales
[editar]En las décadas de los 60 y 70 se especuló con que el aluminio tenía relación con varias enfermedades neurológicas, incluyendo el alzhéimer.[28][29] Desde entonces, múltiples investigaciones epidemiológicas no han descubierto dicha relación entre exposición al aluminio y enfermedades neurológicas.[30][31][32]
Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ «Alumina Trihydrate (ATH)» (en inglés). Huber Engineered Materials. Consultado el 1 de julio de 2017.
- ↑ «Dielectric Constants» [Constantes dieléctricas] (en inglés). Instrumatics. Archivado desde el original el 14 de abril de 2017. Consultado el 1 de julio de 2017.
- ↑ Black, Ronald A.; Hill, D. Ashley (15 de junio de 2003). «Over-the-Counter Medications in Pregnancy» [Medicamento de venta libre]. American Family Physician [Medico familial estadounidense] (en inglés) 67 (12): 2517-2524. ISSN 0002-838X. Consultado el 1 de julio de 2017.
- ↑ a b c Karamalidis, AK; Dzombak DA (2010). Surface Complexation Modeling: Gibbsite (en inglés). John Wiley & Sons. pp. 15-17. ISBN 0-470-58768-7.
- ↑ Valencia, Danna Rodriguez. Hidroxido De Aluminio. Consultado el 2 de julio de 2017.
- ↑ «Gibbsita». Asturnatura.com. Consultado el 2 de julio de 2017.
- ↑ Wells, A.F. (1975). Structural Inorganic Chemistry [Química inorgánica estructural] (en inglés). Oxford: Clarendon Press.
- ↑ a b Evans, KA (1993). «Properties and uses of aluminium oxides and aluminium hydroxides» [Propriedades y usos de los óxidos de aluminio y los hidróxidos de aluminio]. En Downs, A.J., ed. Chemistry of aluminium, gallium, indium, and thallium [Química de aluminio, galio, indio y talio] (en inglés) (1º edición). Londres; Nueva York: Blackie Academic & Professional. ISBN 9780751401035.
- ↑ a b Boundless (26 de julio de 2016). «Basic and Amphoteric Hydroxides» [Hidróxidos básicos y anfotéricos]. Boundless Chemistry (en inglés). Archivado desde el original el 22 de agosto de 2017. Consultado el 2 de julio de 2017.
- ↑ Hind, AR; Bhargava, SK; Grocott, SC (1999). «The Surface Chemistry of Bayer Process Solids: A Review» [La química de superficies de los sólidos del proceso Bayer: Una revista]. Colloids and Surfaces A: Physicochemical and Engineering Aspects (en inglés) 146: 359-74. doi:10.1016/S0927-7757(98)00798-5.
- ↑ «Hungary Battles to Stem Torrent of Toxic Sludge» [Hungría lucha contra el torrente de lodos tóxicos]. BBC (en inglés). 5 de octubre de 2010.
- ↑ Hollingbery, LA; Hull TR (2010). «The Fire Retardant Behaviour of Huntite and Hydromagnesite - A Review» [El comportamiento resistente al fuego de huntita e hidromagnesita]. Polymer Degradation and Stability [Degradación y stabilidad de los polímeros] (en inglés) 95: 2213-2225. doi:10.1016/j.polymdegradstab.2010.08.019.
- ↑ Hollingbery, LA; Hull TR (2010). «The Thermal Decomposition of Huntite and Hydromagnesite - A Review» [El descompone termal de huntita e hidromagnesita]. Thermochimica Acta (en inglés) 509: 1-11. doi:10.1016/j.tca.2010.06.012.
- ↑ Hollingbery, LA; Hull TR (2012). «The Fire Retardant Effects of Huntite in Natural Mixtures with Hydromagnesite» [Los efectos de resistencia a fuego de huntita en mezclas naturales con hidromagnesita]. Polymer Degradation and Stability (en inglés) 97: 504-512. doi:10.1016/j.polymdegradstab.2012.01.024.
- ↑ Hollingbery, LA; Hull TR (2012). «The Thermal Decomposition of Natural Mixtures of Huntite and Hydromagnesite» [La descomposición termal de mezclas naturales de huntita e hidromagnesita]. Thermochimica Acta (en inglés) 528: 45-52. doi:10.1016/j.tca.2011.11.002.
- ↑ Hull, TR; Witkowski A; Hollingbery LA (2011). «Fire Retardant Action of Mineral Fillers» [Acción de resistencia al fuego de los rellenos minerales]. Polymer Degradation and Stability (en inglés) 96: 1462-1469. doi:10.1016/j.polymdegradstab.2011.05.006.
- ↑ Huber Engineered Materials. «Huber Non-Halogen Fire Retardant Additives» (en inglés). Consultado el 3 de julio de 2017.
- ↑ Galbraith, A; Bullock, S; Manias, E; Hunt, B; Richards, A (1999). Fundamentals of pharmacology: a text for nurses and health professionals [Fundamentales de la farmacología: un texto para enfermeras y profesionales de salud] (en inglés). Harlow: Pearson. p. 482.
- ↑ Papich, Mark G (2007). «Aluminum Hydroxide and Aluminum Carbonate». Saunders Handbook of Veterinary Drugs [Manual de Saunders de fármacos veterinarios] (en inglés) (2º edición). San Luis, Misuri: Saunders/Elsevier. pp. 15-16. ISBN 9781416028888.
- ↑ Katzung, Bertram G. (2007). «Chapter 63: Drugs Used in the Treatment of Gastrointestinal Diseases» [Capítulo 63: Fármacos usadas en el tratamiento de enfermedades gastrointestinales]. Basic & Clinical Pharmacology [Farmacología básica y clínica] (en inglés) (9º edición). McGraw-Hill. p. 1471. ISBN 0071451536.
- ↑ Bill, Robert L. (1 de septiembre de 2016). Clinical Pharmacology and Therapeutics for Veterinary Technicians - E-Book [Farmacología clínica y terapéuticas para técnicos veterinarios – ciberlibro] (en inglés). Elsevier Health Sciences. p. 105. ISBN 9780323444026.
- ↑ Plumb, Donald C. (2011). «Aluminum Hydroxide». Plumb's Veterinary Drug Handbook [Manual de Plumb de fármacos veterinarios] (en inglés) (7º edición). Stockholm, Wisconsin; Ames, Iowa: Wiley. pp. 36-37. ISBN 9780470959640.
- ↑ Lifelearn Inc (1 de noviembre de 2010). «Aluminum Hydroxide». Know Your Pet [Conozca a su mascota] (en inglés). Consultado el 30 de junio de 2017.
- ↑ Kool, M; Soullié T; van Nimwegen M; Willart MA; Muskens F; Jung S; Hoogsteden HC; Hammad H et al. (24 de marzo de 2008). «Alum adjuvant boosts adaptive immunity by inducing uric acid and activating inflammatory dendritic cells» [Adyuvantes alumínicos aumentan el inmunitario adaptativo por inducir el ácido úrico y por activar las células dendríticas inflamatorias]. Journal of Experimental Medicine [Revista de la medicina experimental] (en inglés) 205 (4): 869-82. PMC 2807488. PMID 18362170. doi:10.1084/jem.20071087.
- ↑ Petrovsky, N; Aguilar, JC (2004). «Vaccine adjuvants: current state and future trends» [Adyuvantes en las vacunas: estado actual y modas el futuro]. Immunological Cell Biology [Biología celular inmunológica] (en inglés) 82 (5): 488-96. PMID 15479434. doi:10.1111/j.0818-9641.2004.01272.x.
- ↑ Cranage, MP; Robinson, A (2003). Robinson, MJ; Hudson; Cranage, MP, eds. Vaccine Protocols [Protocoles de vacunas]. Methods in Molecular Medicine Biomed Protocols [Métodos en protocoles biomédicos de la medicina molecular] (en inglés) 87 (2º edición). Springer Science. p. 176. ISBN 1-59259-399-2.
- ↑ «Alzheimer's Myths» [Mitos de alzhéimer] (en inglés). Alzheimer's Association [Asociación de alzhéimer]. Consultado el 29 de julio de 2012.
- ↑ Khan, A (1 de septiembre de 2008). «Aluminium and Alzheimer's disease» [Aluminio y la enfermedad de Alzheimer] (en inglés). Alzheimer's Society [Sociedad de alzhéimer]. Archivado desde el original el 11 de marzo de 2012. Consultado el 8 de marzo de 2012.
- ↑ Rondeau, V (2002). «A review of epidemiologic studies on aluminum and silica in relation to Alzheimer's disease and associated disorders» [Una revista de investigaciones epidemiológicas de aluminio y sílice en relación a la enfermedad de Alzheimer y desordenes asociados]. Reviews on Environmental Health [Revistas en la salud del medio ambiente] (en inglés) 17 (2): 107-21. PMC 4764671. PMID 12222737. doi:10.1515/REVEH.2002.17.2.107.
- ↑ Martyn, CN; Coggon, DN; Inskip, H; Lacey, RF; Young, WF (mayo de 1997). «Aluminum concentrations in drinking water and risk of Alzheimer's disease» [Concentraciones de aluminio en agua potable y el riesgo de la enfermedad de Alzheimer]. Epidemiology (en inglés) 8 (3): 281-6. JSTOR 3702254. PMID 9115023. doi:10.1097/00001648-199705000-00009.
- ↑ Graves, AB; Rosner, D; Echeverria, D; Mortimer, JA; Larson, EB (septiembre de 1998). «Occupational exposures to solvents and aluminium and estimated risk of Alzheimer's disease» [Exposiciones ocupacionales a disolventes y aluminio y el riesgo estimado de enfermedad de Alzheimer]. Occup Environ Med (en inglés) 55 (9): 627-33. PMC 1757634. PMID 9861186. doi:10.1136/oem.55.9.627.
Bibliografía
[editar]- Cotrina, Darwin Jair (2011). Impfen Pro & Contra: Das Handbuch für die individuelle Impfentscheidung [Pros y contras de las vacunas: El manual para la decisión individual de vacunar] (en alemán) (ciberlibro edición). Knaur MensSana. pp. 29-52, 121. ISBN 9783426413333.
- Petrik, Michael S.; Wong, Margaret C.; Tabata, Rena C.; Garry, Robert F.; Shaw, Christopher A. (2007). «Aluminum adjuvant linked to Gulf War illness induces motor neuron death in mice» [Adyuvante aluminio ligado a la enfermedad de la Guerra del Golfo induce muerte a las neuronas en ratones]. Neuromolecular Medicine [Medicina neuromuscular] 9 (1): 83-100. ISSN 1559-1174. PMID 17114826. doi:10.1385/NMM:9:1:83.


