Hydrure de magnésium
| Hydrure de magnésium | |||
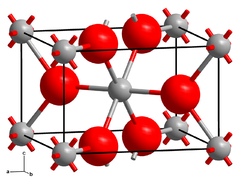
| |||
| __ Mg2+ __ H− Structure cristalline de l'hydrure de magnésium. |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.028.824 | ||
| No CE | 231-705-3 | ||
| PubChem | 5486771 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | H2Mg |
||
| Masse molaire[1] | 26,320 9 ± 0,000 7 g/mol H 7,66 %, Mg 92,34 %, |
||
| Propriétés physiques | |||
| T° fusion | 327 °C[2] (décomposition) | ||
| Masse volumique | 1,45 g·cm-3[3] à 25 °C | ||
| Précautions | |||
| SGH[3] | |||
| H260, H315, H319, P223, P231+P232, P305+P351+P338, P370+P378 et P422 |
|||
| Transport[3] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
L'hydrure de magnésium est un composé chimique de formule MgH2. Il se présente comme une poudre ayant, à température ambiante, la structure cristalline du rutile[4]. On connaît au moins quatre formes à haute pression : le MgH2 β dans le système cristallin cubique avec le groupe d'espace Pa3 (no 205)[5], le MgH2 γ avec la structure du PbO2 α[6], et les formes orthorhombiques HP1 dans le groupe d'espace Pbc21 et HP2 dans le groupe d'espace Pnma[7]. Une variété non-stœchiométrique MgH2-δ a également été caractérisée, mais semble n'exister que sous forme de particules de très petite taille[8], tandis que le MgH2 massif est essentiellement stœchiométrique dans la mesure où il ne permet qu'une faible concentration de lacunes d'hydrogène[9].
Propriétés et réactions
[modifier | modifier le code]La substance est pyrophorique lorsqu'elle est finement divisée, en revanche l'hydrure de magnésium macrocristallin ne s'enflamme spontanément dans l'air qu'au-dessus de 300 °C. Comme la plupart des hydrures métalliques, il réagit violemment avec l'eau en libérant de l'hydrogène :
L'hydrure de magnésium contient une fraction massique de 7,66 % d'hydrogène de sorte qu'il fait l'objet de recherches comme solution de stockage de l'hydrogène[10]. Des procédés ont été décrits pour la synthèse d'hydrure de magnésium à partir des éléments magnésium et hydrogène, mais ils nécessitent ou bien des pressions et des températures élevées, ou bien des catalyseurs de manipulation délicate et qui sont parfois toxiques, ce qui les rend économiquement et écologiquement peu satisfaisants. Par exemple, la réaction peut être réalisée avec un mélange d'iodure d'alkyle, de bromure propargylique et d'iode comme catalyseur[11].
Il est également possible de faire réagir un halogénure de magnésium, tel que l'iodure de magnésium MgI2 dissous dans l'éther diéthylique, avec de l'hydrure de sodium NaH[11] :
L'hydrogénation du magnésium est une réaction exothermique qui s'auto-entretient. C'est également une réaction autocatalytique, l'hydrure de magnésium catalysant sa propre formation. Le produit formé est une poudre grise avec peu d'impuretés de magnésium. D'autre voies de synthèse sont également possibles, comme des dialkyles de magnésium (par exemple du diéthylmagnésium, du dibutylmagnésium, du diphénylmagnésium) ou des réactifs de Grignard correspondants sous un vide poussé[11].
La synthèse directe à partir de magnésium et d'hydrogène a été réalisée en 1951 à 500 °C sous 200 atm en présence d'iodure de magnésium MgI2[12]. Des modes production nécessitant des conditions moins extrêmes ont été explorés, comme l'utilisation de nanocristaux de magnésium obtenus par moulin à billes[13], l'hydrogénation d'anthracène-magnésium en conditions modérées[14], la réaction de diéthylmagnésium avec de l'aluminohydrure de lithium LiAlH4[15] ou encore la production de complexes de MgH2, comme le MgH2·THF en faisant réagir du phénylsilane et du dibutylmagnésium dans de l'éther diéthylique ou des solvants hydrocabonés en présence de THF ou de TMEDA comme ligand[16].
L'hydrure de magnésium se décompose sous 1 bar à partir de 287 °C en libérant de l'hydrogène[17] :
Cette température relativement élevée constitue une limitation à l'utilisation du MgH2 comme matériau de stockage réversible de l'hydrogène[18]. Des recherches ont donc été menées en vue d'améliorer la cinétique des réactions d'hydrogénation et de déshydrogénation[18],[19]. On peut y parvenir en partie par dopage ou en réduisant la taille des particules au moulin à billes[20],[21],[22].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Magnesium hydride, 98% », sur Alfa Aesar (consulté le ).
- Fiche Sigma-Aldrich du composé Magnesium hydride, consultée le 28 octobre 2020.
- (en) W. H. Zachariasen, C. E. Holley et J. F. Stamper Jnr, « Neutron diffraction study of magnesium deuteride », Acta Crystallographica, vol. 16, , p. 352-353 (DOI 10.1107/S0365110X63000967, lire en ligne)
- (en) P. Vajeeston, P. Ravindran, B. C. Hauback, H. Fjellvåg, A. Kjekshus, S. Furuseth et M. Hanfland, « Structural stability and pressure-induced phase transitions in MgH2 », Physical Review B, vol. 73, , article no 224102 (DOI 10.1103/PhysRevB.73.224102, Bibcode 2006PhRvB..73v4102V, lire en ligne)
- (en) M. Bortz, B. Bertheville, G. Böttger et K. Yvon, « Structure of the high pressure phase γ-MgH2 by neutron powder diffraction », Journal of Alloys and Compounds, vol. 287, nos 1-2, , L4-L6 (DOI 10.1016/S0925-8388(99)00028-6, lire en ligne)
- (en) Toru Moriwaki, Yuichi Akahama, Haruki Kawamura, Satoshi Nakano et Kenichi Takemura, « Structural Phase Transition of Rutile-Type MgH2 at High Pressures », Journal of the Physical Society of Japan, vol. 75, no 7, , p. 074603 (DOI 10.1143/JPSJ.75.074603, Bibcode 2006JPSJ...75g4603M, lire en ligne)
- (en) H. Gijs Schimmel, Jacques Huot, Laurent C. Chapon, Frans D. Tichelaar et Fokko M. Mulder, « Hydrogen Cycling of Niobium and Vanadium Catalyzed Nanostructured Magnesium », Journal of the American Chemical Society, vol. 127, no 41, , p. 14348-14354 (PMID 16218629, DOI 10.1021/ja051508a, lire en ligne)
- (en) R. Grau-Crespo, K. C. Smith, T. S. Fisher, N. H. de Leeuw et U. V. Waghmare, « Thermodynamics of hydrogen vacancies in MgH2 from first-principles calculations and grand-canonical statistical mechanics », Physical Review B, vol. 80, no 17, , article no 174117 (DOI 10.1103/PhysRevB.80.174117, Bibcode 2009PhRvB..80q4117G, arXiv 0910.4331, lire en ligne)
- (en) Borislav Bogdanović, « Catalytic Synthesis of Organolithium and Organomagnesium Compounds and of Lithium and Magnesium Hydrides—Applications in Organic Synthesis and Hydrogen Storage », Angewandte Chemie International Edition, vol. 24, no 4, , p. 262-273 (DOI 10.1002/anie.198502621, lire en ligne)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. II, Ferdinand Enke, Stuttgart 1978, p. 902. (ISBN 3-432-87813-3)
- (de) Egon Wiberg, Heinz Goeltzer et Richard Bauer, « Notizen: Synthese von Magnesiumhydrid aus den Elementen », Zeitschrift für Naturforschung B, vol. 6, no 7, , p. 394 (DOI 10.1515/znb-1951-0714, lire en ligne)
- (en) A. Zaluska, L. Zaluski et J. O. Ström–Olsen, « Nanocrystalline magnesium for hydrogen storage », Journal of Alloys and Compounds, vol. 288, nos 1-2, , p. 217-225 (DOI 10.1016/S0925-8388(99)00073-0, lire en ligne)
- (en) Borislav Bogdanović, Shih‐tsien Liao, Manfred Schwickardi, Peter Sikorsky et Bernd Spliethoff, « Catalytic Synthesis of Magnesium Hydride under Mild Conditions », Angwandte Chemie International Edition, vol. 19, no 10, , p. 818-819 (DOI 10.1002/anie.198008181, lire en ligne)
- (en) Glenn D. Barbaras, Clyde Dillard, A. E. Finholt, Thomas Wartik, K. E. Wilzbach et H. I. Schlesinger, « The Preparation of the Hydrides of Zinc, Cadmium, Beryllium, Magnesium and Lithium by the Use of Lithium Aluminum Hydride », The Journal of the American Chemical Society, vol. 73, no 10, , p. 4585-4590 (DOI 10.1021/ja01154a025, lire en ligne)
- (en) Michael J. Michalczyk, « Synthesis of magnesium hydride by the reaction of phenylsilane and dibutylmagnesium », Organometallics, vol. 11, no 6, , p. 2307-2309 (DOI 10.1021/om00042a055, lire en ligne)
- (en) T. R. McAuliffe, Hydrogen and Energy, édition illustrée, Springer, 1980, p. 65. (ISBN 978-1-349-02635-7)
- (en) Louis Schlapbach et Andreas Züttel, « Hydrogen-storage materials for mobile applications », Nature, vol. 414, no 6861, , p. 353-358 (PMID 11713542, DOI 10.1038/35104634, Bibcode 2001Natur.414..353S, lire en ligne)
- (en) J. Huot, « Hydrogen in Metals », New Trends in Intercalation Compounds for Energy Storage, Christian Julien, J. P. Pereira-Ramos, A. Momchilov, Springer, 2002. (ISBN 1-4020-0594-6)
- (en) Billur Sakintuna, Farida Lamari-Darkrim et Michael Hirscher, « Metal hydride materials for solid hydrogen storage: A review », International Journal of Hydrogen Energy, vol. 32, no 9, , p. 1121-1140 (DOI 10.1016/j.ijhydene.2006.11.022, lire en ligne)
- (en) Kyle C. Smith, Timothy S. Fisher, Umesh V. Waghmare et Ricardo Grau-Crespo, « Dopant-vacancy binding effects in Li-doped magnesium hydride », Physical Review B, vol. 82, no 13, , article no 134109 (DOI 10.1103/PhysRevB.82.134109, Bibcode 2010PhRvB..82m4109S, lire en ligne)
- (en) G. Liang, J. Huot, S. Boily, A. Van Neste et R. Schulz, « Catalytic effect of transition metals on hydrogen sorption in nanocrystalline ball milled MgH2–Tm (Tm=Ti, V, Mn, Fe and Ni) systems », Journal of Alloys and Compounds, vol. 292, nos 1-2, , p. 247-252 (DOI 10.1016/S0925-8388(99)00442-9, lire en ligne)



