Ippocampo (anatomia)
| Ippocampo | |
|---|---|
 | |
 | |
| Nome latino | Hippocampus |
| Localizzazione anatomica | lobo temporale |
| Identificatori | |
| MeSH | A08.186.211.180.405 e A08.186.211.200.885.287.500.345 |
| TA | A14.1.09.321 |
| FMA | 275020 |
| ID NeuroLex | birnlex_721 |
L'ippocampo è una parte del cervello situata nella regione interna del lobo temporale. Fa parte della formazione dell'ippocampo, inserito nel sistema limbico, e svolge un ruolo importante nella formazione delle memorie esplicite (dichiarativa e semantica), nella trasformazione della memoria a breve termine in memoria a lungo termine e nella navigazione spaziale. L'ippocampo si trova sotto la corteccia cerebrale nell'allocorteccia.[1][2] e nei primati è nel lobo temporale mediale. Contiene due parti principali a incastro: l'ippocampo proprio (chiamato anche corno di Ammon)[3] e il giro dentato.
Gli esseri umani e gli altri mammiferi possiedono due ippocampi, uno in ogni emisfero del cervello. Nei roditori, animali in cui l'ippocampo è stato studiato in maniera approfondita, l'ippocampo ha all'incirca la forma di una banana. Nell'essere umano, ha una forma curva e convoluta, che ispirò ai primi anatomisti l'immagine di un cavalluccio marino. Il nome, infatti, deriva dal greco (hippos = cavallo, kàmpe = bruco).
Nella malattia di Alzheimer, l'ippocampo è una delle prime regioni del cervello a soffrire dei danni; deficit di memoria e disorientamento sono i primi sintomi che compaiono. Lesioni all'ippocampo possono occorrere anche come conseguenza di mancanza di ossigeno (anossia), encefalite o epilessia del lobo temporale mediale. Le persone che presentano danni estesi al tessuto ippocampale possono mostrare amnesia anterograda, cioè incapacità di formare o mantenere nuovi ricordi.
Poiché diversi tipi di cellule neuronali sono ordinatamente organizzati in strati nell'ippocampo, è stato spesso usato come sistema modello per studiare la neurofisiologia. La plasticità neurale nota come potenziamento a lungo termine (LTP) è stata inizialmente scoperta nell'ippocampo ed è stata spesso studiata in questa struttura. Si ritiene che l'LTP sia uno dei principali meccanismi neurali mediante i quali i ricordi sono immagazzinati nel cervello.
Storia
[modifica | modifica wikitesto]Fu l'anatomista Giulio Cesare Aranzi (nel 1564 circa) a utilizzare per primo il termine ippocampo per descrivere questo organo cerebrale a causa della sua somiglianza con il cavalluccio marino. Questo organo fu inizialmente collegato al senso dell'olfatto e non alle sue funzioni nell'ambito della formazione delle tracce di memoria. Attorno al 1900 il russo Vladimir Bechterev notò il ruolo dell'ippocampo nelle funzioni mnemoniche, basandosi sull'osservazione di un paziente con gravi disturbi di memoria. A ogni modo, per parecchi anni, il ruolo attribuito all'ippocampo fu, come il resto del sistema limbico, quello di responsabile delle emozioni.
L'importanza dell'ippocampo nei processi di memoria fu portato all'attenzione dei ricercatori dal paziente H.M. H.M. soffriva di diversi deficit della memoria anterograda e cronologici (disturbi di questo genere sono diventati poi soggetto di film) a seguito della rimozione bilaterale di diverse strutture del lobo temporale mediale (inclusa l'ablazione bilaterale degli ippocampi) per prevenire le frequenti crisi epilettiche. Rilevante fu l'osservazione che H.M. era ancora in grado di apprendere i compiti procedurali (associati al tessuto striato), e che il suo QI era rimasto al di sopra della media. Il caso di H.M. dimostrò la dissociazione tra intelligenza e memoria dichiarativa. Le dimensioni relative della formazione ippocampale in relazione al volume totale del cervello sono spesso conservate nella maggior parte delle specie di mammiferi, anche se si è riscontrata una certa ipotrofia nei cetacei.
Anatomia
[modifica | modifica wikitesto]
Anatomicamente, l'ippocampo è un'elaborazione del bordo della corteccia. Si può distinguere come zona a sé stante dove la corteccia si assottiglia in uno strato singolo di neuroni densamente organizzati, che si piega a formare una S molto stretta. La struttura che si allinea al bordo della corteccia forma il cosiddetto sistema limbico (dal latino limbus = limite): questo include l'ippocampo, la corteccia del cingolo, la corteccia olfattiva e l'amigdala. Paul MacLean ha suggerito, nella sua teoria del Triunbrain (cervello trino), che le strutture limbiche costituiscono la base neurale delle emozioni. Tuttavia, la maggior parte dei neuroscienziati non considerano più come valido il concetto di "sistema limbico unificato".
Fisiologia
[modifica | modifica wikitesto]L'ippocampo mostra due principali "modalità" di attività, ciascuna delle quali associata a un distinto pattern di onde EEG e di attività di popolazione neurale. Queste modalità prendono il nome dai pattern EEG a esse associate: theta e LIA (large irregular activity - ampia attività irregolare). Qui si trovano alcune delle loro maggiori caratteristiche nel ratto, l'animale più ampiamente studiato:[4]
L'ippocampo sembra avere un'importante posizione nell'apprendimento di natura spaziale (nell'emisfero destro) e nell'apprendimento di natura semantica (nell'emisfero sinistro). Nel ratto si è osservata la presenza di place cell che come per i campi recettivi sembrano attivarsi a seguito dell'occupazione di una determinata regione spaziale.

L'ippocampo può essere considerato come uno "spazio di memoria" nel quale le informazioni multisensoriali collegate a una memoria dichiarativa (episodica e semantica) si integrerebbero per un breve periodo. Successivamente verranno inviate a regioni paraippocampali che dissociandole ne faranno una memoria più duratura.
Funzioni dell'ippocampo
[modifica | modifica wikitesto]Forse la prima ipotesi supponeva l'ippocampo coinvolto nell'olfatto, ipotesi suggerita principalmente dalla sua localizzazione all'interno del cervello, vicino alla corteccia olfattiva. Continua a permanere un certo interesse per il coinvolgimento dell'ippocampo nelle funzioni olfattive, ma non è l'olfatto la funzione primaria dell'ippocampo.
Negli anni sulla funzione dell'ippocampo si sono avute tre idee dominanti: l'inibizione, la memoria e lo spazio. La teoria dell'inibizione comportamentale (ironicamente definita da O'Keefe e Nadel "un piede sul freno"), popolare fino agli anni 1960, traeva origine da due osservazioni: in primo luogo, gli animali il cui ippocampo era danneggiato tendevano a essere iperattivi; la seconda, che gli animali con danni al tessuto ippocampale mostravano spesso difficoltà ad apprendere a inibire risposte che erano state loro insegnate prima. Jeffrey Gray sviluppò questa linea di pensiero in una teoria vera e propria sul ruolo dell'ippocampo negli stati d'ansia[6]. La teoria dell'inibizione non è oggi molto considerata, dal momento che questa e altre funzioni sono attualmente attribuite all'amigdala, struttura anatomicamente vicina all'ippocampo.
La seconda importante linea di pensiero associa la funzione dell'ippocampo alla memoria. Quella che riveste maggiore importanza è contenuta nel celebre trattato di Scoville e Milner[7] sulle conseguenze della distruzione chirurgica dell'ippocampo (nel tentativo di eliminare le crisi dell'epilessia), osservate in un paziente chiamato H.M. Il paziente presentava una grave amnesia, e non ricordava che cosa gli fosse accaduto dopo l'operazione o eventi accaduti in precedenza, anche in un lasso temporale di anni. Ciò destò un interesse tale da far sì che H.M. sia il caso medico più studiato della storia. Negli anni seguenti, altri pazienti che presentavano simili disfunzioni mnemoniche legate a lesioni ippocampali (dovute a incidenti o malformazioni congenite) furono studiati con la stessa intensità, e furono effettuati migliaia di esperimenti riguardanti la fisiologia della plasticità neurale nell'ippocampo. Oggi non vi sono quasi più divergenze sull'importanza dell'ippocampo, considerato universalmente come sede della memoria. Tuttavia, il ruolo specifico che gioca in relazione a questa funzione psichica rimane tuttora oggetto di dibattiti.[8][9]
Ruolo nella memoria generale
[modifica | modifica wikitesto]Gli psicologi e i neuroscienziati generalmente concordano nell'affermare che l'ippocampo svolge un ruolo importante nella formazione di nuove memorie riguardanti eventi vissuti (memoria episodica o memoria autobiografica)[9][10]. Alcuni ricercatori preferiscono considerare l'ippocampo come parte di un più ampio sistema mnemonico del lobo temporale mediale, responsabile in generale della memoria dichiarativa (i ricordi che possono essere esplicitamente verbalizzati come la memoria semantica oltre che la memoria episodica)[8].
Alcune prove sostengono l'ipotesi che, sebbene alcune forme di memoria possano perdurare tutta la vita, l'ippocampo smetta di svolgere un ruolo cruciale nella ritenzione del ricordo dopo un periodo di consolidamento[11]. I danni all'ippocampo generalmente portano a gravi difficoltà nella formazione di nuovi ricordi (amnesia anterograda) e normalmente è danneggiato anche l'accesso ai ricordi precedenti al danno (amnesia retrograda). Anche se l'effetto retrogrado può estendersi ad alcuni anni precedenti al danno, in alcuni casi i ricordi più remoti permangono – questo risparmio di memorie più vecchie ha portato all'idea che il consolidamento nel tempo comporti il trasferimento delle memorie al di fuori dell'ippocampo, verso altre parti del cervello. Tuttavia, la sperimentazione incontra grandi difficoltà nel misurare il permanere di queste memorie più antiche; inoltre, in alcuni casi di amnesia retrograda, questo permanere sembra coinvolgere ricordi formatisi decine di anni prima all'occorrere della lesione ippocampale, perciò il suo ruolo nel mantenimento di queste remote memorie rimane dubbio.
Danni all'ippocampo non hanno effetti su alcuni aspetti della memoria, come ad esempio la capacità di acquisire nuove abilità motorie (ad es. suonare uno strumento musicale): ciò suggerisce che questi tipi di abilità dipendano da un tipo diverso di memoria (memoria procedurale) e da differenti regioni cerebrali. Ci sono inoltre prove che il paziente H.M. (a cui furono asportati bilateralmente i lobi temporali mediali come trattamento per l'epilessia[7]) sia in grado di formare nuova memoria semantica.[12]
Elettroencefalografia
[modifica | modifica wikitesto]L'ippocampo mostra due principali "modalità" di attività, ognuna associata a un modello distinto di attività della popolazione neurale e onde di attività elettrica misurate da un elettroencefalogramma (EEG). Queste modalità prendono il nome dai modelli EEG a esse associati: onde theta e grande attività irregolare (large irregular activity o LIA). Le caratteristiche principali descritte di seguito sono per il ratto, che è l'animale più studiato.[13]

La modalità theta appare durante gli stati di comportamento attivo, attento (specialmente la locomozione), e anche durante il sonno REM (sognando).[14] Nella modalità theta, l'EEG è dominato da grandi onde regolari con un intervallo di frequenza da 6 a 9 Hz, e i principali gruppi di neuroni dell'ippocampo (cellule piramidali e granuli) mostrano un'attività di popolazione scarsa, il che significa che in qualsiasi intervallo di tempo breve, la stragrande maggioranza delle celle è silenziosa, mentre la piccola frazione rimanente spara a velocità relativamente elevate, fino a 50 picchi in un secondo per i più attivi. Una cella attiva rimane in genere attiva da mezzo secondo a pochi secondi. Man mano che il ratto si muove, le cellule attive diventano silenziose e le nuove cellule diventano attive, ma la percentuale complessiva di cellule attive rimane più o meno costante. In molte situazioni, l'attività cellulare è determinata in gran parte dalla posizione spaziale dell'animale, ma anche altre variabili comportamentali la influenzano chiaramente.
La modalità LIA appare durante il sonno a onde lente (non sognando) e anche durante gli stati di immobilità da veglia come il riposo o il mangiare.[15] Nella modalità LIA, l'EEG è dominato da onde acute che sono grandi deflessioni temporizzate del segnale EEG che durano per 25-50 millisecondi. Le onde acute sono spesso generate in serie, con serie che contengono fino a 5 o più onde singole individuali e durano fino a 500 ms. L'attività di spionaggio dei neuroni all'interno dell'ippocampo è fortemente correlata con l'attività delle onde acute. La maggior parte dei neuroni diminuisce la frequenza di sparo tra onde acute; tuttavia, durante un'onda acuta, c'è un drammatico aumento del tasso di sparo fino al 10% della popolazione dell'ippocampo
Queste due modalità di attività dell'ippocampo possono essere osservate sia nei primati sia nei ratti, con l'eccezione che è stato difficile vedere una ritmicità theta robusta nell'ippocampo dei primati. Vi sono, tuttavia, onde acute qualitativamente simili e cambiamenti delle onde dipendenti dallo stato nell'attività della popolazione neurale.
Fisiopatologia
[modifica | modifica wikitesto]Malattia di Alzheimer
[modifica | modifica wikitesto]Condizioni legate all'età come il morbo di Alzheimer e altre forme di demenza (per le quali un danno dell'ippocampo è uno dei primi segni[16]) hanno un grave impatto su molti tipi di cognizione, inclusa la memoria. Anche il normale invecchiamento è associato a un graduale declino di alcuni tipi di memoria, tra cui la memoria episodica e la memoria di lavoro (o memoria a breve termine). Poiché si ritiene che l'ippocampo abbia un ruolo centrale nella memoria, c'è stato un notevole interesse nella possibilità che il declino legato all'età possa essere causato dal deterioramento dell'ippocampo.[17] Alcuni primi studi hanno riportato una sostanziale perdita di neuroni nell'ippocampo degli anziani, ma studi successivi che hanno utilizzato tecniche più precise hanno riscontrato solo differenze minime.[17] Allo stesso modo, alcuni studi di risonanza magnetica hanno riportato un restringimento dell'ippocampo negli anziani, ma altri studi non sono riusciti a riprodurre questo risultato. Esiste, tuttavia, una relazione affidabile tra le dimensioni dell'ippocampo e le prestazioni della memoria; in modo che laddove vi sia una riduzione legata all'età, le prestazioni della memoria saranno compromesse.[18] Ci sono anche prove che le attività di memoria tendono a produrre meno attivazione dell'ippocampo negli anziani rispetto ai giovani.[18] Inoltre, uno studio randomizzato di controllo pubblicato nel 2011 ha rilevato che l'esercizio aerobico potrebbe aumentare le dimensioni dell'ippocampo negli adulti di età compresa tra 55 e 80 anni e migliorare anche la memoria spaziale.
Nella malattia di Alzheimer la corteccia associativa: temporale, prefrontale e parietale, è sede di deposito anormale di β-amiloide. Nei prolungamenti neuronali si rileva invece il deposito di proteine Tau anomalamente iperfosforilate. Queste formano ammassi neurofibrillari rinvenuti in grande quantità nelle regioni interne del lobo temporale e in particolare nell'ippocampo. I neuroni i cui prolungamenti sono stati sede di ammassi neurofibrillari vengono persi. Questo conduce all'atrofia delle regioni affette.
Stress
[modifica | modifica wikitesto]L'ippocampo contiene alti livelli di recettori dei glucocorticoidi, che lo rendono più vulnerabile allo stress a lungo termine rispetto alla maggior parte delle altre aree del cervello.[19] Vi sono prove che gli esseri umani che hanno sperimentato uno stress traumatico grave e di lunga durata mostrano atrofia dell'ippocampo più che di altre parti del cervello. Questi effetti si manifestano nel disturbo post traumatico da stress,[20] e possono contribuire all'atrofia dell'ippocampo riportata nella schizofrenia[21] e nella depressione grave.[22] Un recente studio ha anche rivelato l'atrofia a causa della depressione, ma questo può essere fermato con gli antidepressivi anche se non sono efficaci nell'alleviare altri sintomi.[22]
Lo stress cronico che provoca livelli elevati di glucocorticoidi, in particolare cortisolo, è considerato una causa di atrofia neuronale nell'ippocampo. Questa atrofia si traduce in un volume dell'ippocampo più piccolo che si vede anche nella sindrome di Cushing. I livelli più alti di cortisolo nella sindrome di Cushing sono generalmente il risultato di farmaci assunti per altre condizioni.[23] La perdita neuronale si verifica anche a causa della neurogenesi compromessa. Un altro fattore che contribuisce a ridurre il volume dell'ippocampo è quello della retrazione dendritica in cui i dendriti sono accorciati in lunghezza e ridotti in numero, in risposta all'aumento dei glucocorticoidi. Questa retrazione dendritica è reversibile.[24] Dopo il trattamento con farmaci per ridurre il cortisolo nella sindrome di Cushing, il volume dell'ippocampo viene ripristinato fino al 10%. Questo cambiamento è dovuto al cambiamento dei dendriti.[24] Questo ripristino dendritico può avvenire anche quando viene rimosso lo stress. Vi sono, tuttavia, prove derivate principalmente da studi condotti su ratti che lo stress che si verifica poco dopo la nascita può influenzare la funzione dell'ippocampo in modi che persistono per tutta la vita.
Nel ratto è stato anche dimostrato che le risposte sessuali specifiche allo stress hanno un effetto sull'ippocampo. Lo stress cronico nel ratto maschio ha mostrato retrazione dendritica e perdita di cellule nella regione CA3, ma ciò non è stato dimostrato nella femmina. Si pensava che ciò fosse dovuto agli ormoni ovarici neuroprotettivi.[25] Nei ratti, il danno al DNA aumenta nell'ippocampo in condizioni di stress.[26]
Epilessia
[modifica | modifica wikitesto]
L'ippocampo è una delle poche regioni del cervello in cui vengono generati nuovi neuroni. Questo processo di neurogenesi è limitato al giro dentato.[27] La produzione di nuovi neuroni può essere influenzata positivamente dall'esercizio o negativamente da convulsioni epilettiche.[27]

Le convulsioni nell'epilessia del lobo temporale possono influenzare il normale sviluppo di nuovi neuroni e possono causare danni ai tessuti. La sclerosi ippocampale è il tipo più comune di tale danno tissutale.[28] Non è ancora chiaro, tuttavia, se l'epilessia sia solitamente causata da anomalie dell'ippocampo o se l'ippocampo sia danneggiato dagli effetti cumulativi delle convulsioni.[29] Tuttavia, in contesti sperimentali in cui le convulsioni sono indotte artificialmente negli animali, il danno dell'ippocampo è un risultato frequente. Ciò può essere una conseguenza della concentrazione di recettori del glutammato eccitabili nell'ippocampo. L'ipereccitabilità può portare alla citotossicità e alla morte cellulare. Potrebbe anche avere a che fare con l'ippocampo che è un sito in cui i nuovi neuroni continuano a essere creati per tutta la vita e alle anomalie in questo processo.[30]
Galleria d'immagini
[modifica | modifica wikitesto]-
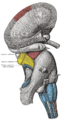
Dissezione superficiale della radice del cervello. Visione laterale.
-
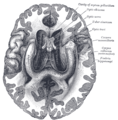
Sezione del cervello
-
Ventricolo sinistro
-
Corno inferiore e posteriore, visti dall'alto
-
Il fornice e il corpo calloso visti dal basso
-
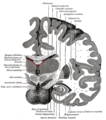
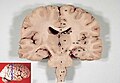
Sezione frontale (coronale) del cervello)
-
Cervello umano sezionato
-
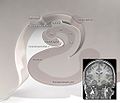
Diagramma dell'ippocampo
-
Aree dell'ippocampo
-
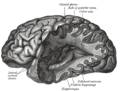
Forma caratteristica dell'ippocampo
Note
[modifica | modifica wikitesto]- ^ (EN) John Martin, Neuroanatomy: Text and Atlas, McGraw Hill Professional, 2003, ISBN 978-0-07-138183-3. URL consultato il 30 aprile 2020.
- ^ (EN) Per Andersen, Richard Morris e David Amaral, The Hippocampus Book, Oxford University Press, USA, 2007, ISBN 978-0-19-510027-3. URL consultato il 30 aprile 2020.
- ^ J PEARCE, Ammon's horn and the hippocampus, in Journal of Neurology, Neurosurgery, and Psychiatry, vol. 71, n. 3, 2001-9, p. 351, DOI:10.1136/jnnp.71.3.351. URL consultato il 30 aprile 2020.
- ^ Vedi bibliografia: Buzsaki, 2006
- ^ Vedi bibliografia: Skaggs et al., 1996
- ^ Vedi bibliografia: Gray and McNaughton, 2000
- ^ a b Vedi bibliografia: Scoville and Milner, 1957
- ^ a b Vedi bibliografia: Squire, 1992
- ^ a b Vedi bibliografia: Eichenbaum and Cohen, 1993
- ^ Vedi bibliografia: Squire and Schacter, 2002
- ^ Vedi bibliografia: Squire and Schacter, 2002, Ch. 1
- ^ Vedi bibliografia: O'Kane et al., 2004
- ^ Buzsáki, G., Rhythms of the brain, Oxford University Press, 2006, ISBN 978-0-19-804125-2, OCLC 71338388. URL consultato il 30 aprile 2020.
- ^ (EN) György Buzsáki, Lan S. Chen e Fred H. Gage, Progress in Brain Research, collana Understanding the Brain Through the Hippocampus the Hippocampal Region as a Model for Studying Brain Structure and Function, vol. 83, Elsevier, 1º gennaio 1990, pp. 257-268. URL consultato il 30 aprile 2020.
- ^ (EN) György Buzsáki, Theta Oscillations in the Hippocampus, in Neuron, vol. 33, n. 3, 31 gennaio 2002, pp. 325-340, DOI:10.1016/S0896-6273(02)00586-X. URL consultato il 30 aprile 2020.
- ^ Harald Hampel, Katharina Bürger e Stefan J. Teipel, Core candidate neurochemical and imaging biomarkers of Alzheimer's disease, in Alzheimer's & Dementia, vol. 4, n. 1, 1º gennaio 2008, pp. 38-48, DOI:10.1016/j.jalz.2007.08.006. URL consultato il 30 aprile 2020.
- ^ a b Prull MW, Gabrieli JD, Bunge SA (2000). "Ch 2. Age-related changes in memory: A cognitive neuroscience perspective". In Craik FI, Salthouse TA (eds.). The handbook of aging and cognition. Erlbaum.
- ^ a b (EN) F. Rodrı́guez, J. C. López e J. P. Vargas, Spatial memory and hippocampal pallium through vertebrate evolution: insights from reptiles and teleost fish, in Brain Research Bulletin, vol. 57, n. 3, 1º febbraio 2002, pp. 499-503, DOI:10.1016/S0361-9230(01)00682-7. URL consultato il 30 aprile 2020.
- ^ (EN) Marian Joëls, Functional actions of corticosteroids in the hippocampus, in European Journal of Pharmacology, vol. 583, n. 2, 7 aprile 2008, pp. 312-321, DOI:10.1016/j.ejphar.2007.11.064. URL consultato il 30 aprile 2020.
- ^ (EN) Anke Karl, Michael Schaefer e Loretta S. Malta, A meta-analysis of structural brain abnormalities in PTSD, in Neuroscience & Biobehavioral Reviews, vol. 30, n. 7, 1º gennaio 2006, pp. 1004-1031, DOI:10.1016/j.neubiorev.2006.03.004. URL consultato il 30 aprile 2020.
- ^ Ian C. Wright, Sophia Rabe-Hesketh e Peter W.R. Woodruff, Meta-Analysis of Regional Brain Volumes in Schizophrenia, in American Journal of Psychiatry, vol. 157, n. 1, 1º gennaio 2000, pp. 16-25, DOI:10.1176/ajp.157.1.16. URL consultato il 30 aprile 2020.
- ^ a b (EN) Matthew J. Kempton, Zainab Salvador e Marcus R. Munafò, Structural Neuroimaging Studies in Major Depressive Disorder: Meta-analysis and Comparison With Bipolar Disorder, in Archives of General Psychiatry, vol. 68, n. 7, 4 luglio 2011, pp. 675-690, DOI:10.1001/archgenpsychiatry.2011.60. URL consultato il 30 aprile 2020.
- ^ (EN) Institute of Medicine (US) Forum on Neuroscience and Nervous System Disorders, Overview of the Glutamatergic System, National Academies Press (US), 2011. URL consultato il 30 aprile 2020.
- ^ a b Garcia-Segura, Luis Miguel., Hormones and brain plasticity, Oxford University Press, 2009, ISBN 978-0-19-971682-1, OCLC 373185473. URL consultato il 30 aprile 2020.
- ^ Cheryl D. Conrad, Chronic Stress-Induced Hippocampal Vulnerability: The Glucocorticoid Vulnerability Hypothesis, in Reviews in the neurosciences, vol. 19, n. 6, 2008, pp. 395-411. URL consultato il 30 aprile 2020.
- ^ (EN) A. R. Consiglio, A. L. L. P. Ramos e J. A. P. Henriques, DNA brain damage after stress in rats, in Progress in Neuro-Psychopharmacology and Biological Psychiatry, vol. 34, n. 4, 30 maggio 2010, pp. 652-656, DOI:10.1016/j.pnpbp.2010.03.004. URL consultato il 30 aprile 2020.
- ^ a b Ramkumar Kuruba, Bharathi Hattiangady e Ashok K. Shetty, Hippocampal Neurogenesis and Neural Stem Cells in Temporal Lobe Epilepsy, in Epilepsy & behavior : E&B, vol. 14, Suppl 1, 2009-1, pp. 65-73, DOI:10.1016/j.yebeh.2008.08.020. URL consultato il 30 aprile 2020.
- ^ Bernard S. Chang e Daniel H. Lowenstein, Epilepsy, in New England Journal of Medicine, vol. 349, n. 13, 25 settembre 2003, pp. 1257-1266, DOI:10.1056/NEJMra022308. URL consultato il 30 aprile 2020.
- ^ (EN) Robert S. Sloviter, The neurobiology of temporal lobe epilepsy: too much information, not enough knowledge, in Comptes Rendus Biologies, vol. 328, n. 2, 1º febbraio 2005, pp. 143-153, DOI:10.1016/j.crvi.2004.10.010. URL consultato il 30 aprile 2020.
- ^ (EN) Ramkumar Kuruba, Bharathi Hattiangady e Ashok K. Shetty, Hippocampal neurogenesis and neural stem cells in temporal lobe epilepsy, in Epilepsy & Behavior, vol. 14, n. 1, 1º gennaio 2009, pp. 65-73, DOI:10.1016/j.yebeh.2008.08.020. URL consultato il 30 aprile 2020.
Bibliografia
[modifica | modifica wikitesto]- F Aboitiz, Morales D, Montiel J, The evolutionary origin of the mammalian isocortex: Towards an integrated developmental and functional approach, in Behav. Brain Sciences, vol. 26, 2003, pp. 535-552, PMID 15179935.
- D Amaral, Lavenex P, Ch 3. Hippocampal Neuroanatomy, in Andersen P, Morris R, Amaral D, Bliss T, O'Keefe J (a cura di), The Hippocampus Book, Oxford University Press, 2006, ISBN 978-0-19-510027-3.
- C Broglio, Gómez A, Durán E, Ocaña FM, Jiménez-Moya F, Rodríguez F, Salas C, Hallmarks of a common forebrain vertebrate plan: Specialized pallial areas for spatial, temporal and emotional memory in actinopterygian fish, in Brain Res. Bull., vol. 57, 2002, pp. 397-399, PMID =16144602.
- G Buzsáki, Theta oscillations in the hippocampus (PDF), in Neuron, vol. 33, 2002, pp. 325-340, PMID =11832222 (archiviato dall'url originale il 25 giugno 2008).
- G Buzsáki, Rhythms of the Brain, Oxford University Press, 2006, ISBN 0-19-530106-4.
- JL Cantero, Atienza M, Stickgold R, Kahana MJ, Madsen JR, Kocsis B, Sleep-dependent theta oscillations in the human hippocampus and neocortex, in J. Neurosci., vol. 23, 2003, pp. 10897-10903, PMID =14645485.
- M Colombo, Broadbent N, Is the avian hippocampus a functional homologue of the mammalian hippocampus?, in Neurosci. Biobehav. Rev., vol. 24, 2000, pp. 465-484, PMID 10817844.
- H Eichnbaum, Cohen NJ, Memory, Amnesia, and the Hippocampal System, MIT Press, 1993.
- AD Ekstrom, Kahana MJ, Caplan JB, Fields TA, Isham EA, Newman EL, Fried I, Cellular networks underlying human spatial navigation (PDF), in Nature, vol. 425, 2003, pp. 184-188, PMID =12968182. URL consultato il 19 aprile 2008 (archiviato dall'url originale l'11 maggio 2008).
- JA Gray, McNaughton N, The Neuropsychology of Anxiety: An Enquiry into the Functions of the Septo-Hippocampal System, Oxford University Press, 2000.
- JD Green, Arduini AA, Hippocampal electrical activity in arousal, in J. Neurophysiol., vol. 17, 1954, pp. 533-557, PMID =13212425.
- LF Jacobs, Gaulin SJ, Sherry DF, Hoffman GE, Evolution of spatial cognition: sex-specific patterns of spatial behavior predict hippocampal size, in PNAS, vol. 87, 1990, pp. 6349-6352, PMID 2201026.
- LF Jacobs, The Evolution of the Cognitive Map, in Brain Behav. Evol., vol. 62, 2003, pp. 128-139, DOI:10.1159/000072443, PMID 12937351.
- IJ Kirk, McNaughton N, Supramammillary cell firing and hippocampal rhythmical slow activity, in Neuroreport, vol. 11, 1991, pp. 723-725, PMID =1810464.
- EA Maguire, Gadian DG, Johnsrude IS, Good CD, Ashburner J, Frackowiak RS, Frith CD, Navigation-related structural change in the hippocampi of taxi drivers, in PNAS, vol. 97, 2000, pp. 4398-4403, DOI:10.1073/pnas.070039597, PMID =10716738.
- BL McNaughton, Battaglia FP, Jensen O, Moser EI, Moser MB, Path integration and the neural basis of the 'cognitive map', in Nat. Rev. Neurosci., vol. 7, 2006, pp. 663-678, PMID =16858394.
- EI Moser, Kropf E, Moser M-B, Place Cells, Grid Cells, and the Brain's Spatial Representation System, in Ann. Rev. Neurosci., vol. 31, 2008, DOI:10.1146/annurev.neuro.31.061307.090723.
- R Nieuwenhuys, An Overview of the Organization of the Brain of Actinopterygian Fishes, in Am. Zool., vol. 22, 1982, pp. 287-310, DOI:10.1093/icb/22.2.287.
- G O'Kane, Kensinger EA, Corkin S, Evidence for semantic learning in profound amnesia: An investigation with patient H.M., in Hippocampus, vol. 14, 2004, pp. 417-425, PMID =15224979 (archiviato dall'url originale il 9 dicembre 2012).
- J O'Keefe, Nadel L, The Hippocampus as a Cognitive Map, Oxford University Press, 1978. URL consultato il 19 aprile 2008 (archiviato dall'url originale il 24 marzo 2011).
- M Portavella, Vargas JP, Torres B, Salas C, The effects of telencephalic pallial lesions on spatial, temporal, and emotional learning in goldfish, in Brain Res. Bull., vol. 57, 2002, pp. 397-399, PMID =11922997.
- F Rodríguez, Lópeza JC, Vargasa JP, Broglioa C, Gómeza Y, Salas C, Spatial memory and hippocampal pallium through vertebrate evolution: insights from reptiles and teleost fish, in Brain Res. Bull., vol. 57, 2002, pp. 499-503, PMID 11923018.
- RS Sainsbury, Heynen A, Montoya CP, Behavioral correlates of hippocampal type 2 theta in the rat, in Physiol. Behav., vol. 39, 1987, pp. 513-519, PMID =3575499.
- WB Scoville, Milner B, Loss of Recent Memory After Bilateral Hippocampal Lesions, in J. Neurol. Neurosurg. Psych., vol. 20, 1957, pp. 11-21. URL consultato il 19 aprile 2008 (archiviato dall'url originale il 4 maggio 2008).
- SJ Shettleworth, Memory and Hippocampal Specialization in Food-Storing Birds: Challenges for Research on Comparative Cognition, in Brain Behav. Evol., vol. 62, 2003, pp. 108-116, PMID 12937349.
- WE Skaggs, McNaughton BL, Wilson MA, Barnes CA, Theta phase precession in hippocampal neuronal populations and the compression of temporal sequences [collegamento interrotto], in Hippocampus, vol. 6, 1996, pp. 149-176, PMID 8797016.
- LR Squire, Memory and the hippocampus: a synthesis from findings with rats, monkeys, and humans, in Psych. Rev., vol. 99, 1992, pp. 195-231.
- LR Squire, Schacter DL, The Neuropsychology of Memory, Guilford Press, 2002.
- CH Vanderwolf, Hippocampal electrical activity and voluntary movement in the rat, in EEG & Clin. Neurophysiol., vol. 26, 1969, pp. 407-418, PMID =4183562.
- JP Vargas, Bingman VP, Portavella M, López JC, Telencephalon and geometric space in goldfish, in Eur. J. Neurosci., vol. 24, 2006, pp. 2870-2878, PMID =17156211.
- MJ West, Stereological studies of the hippocampus: a comparison of the hippocampal subdivisions of diverse species including hedgehogs, laboratory rodents, wild mice and men., in Prog. Brain Res., vol. 83, 1990, pp. 13-36, PMID =2203095.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikiquote contiene citazioni sull'ippocampo
Wikiquote contiene citazioni sull'ippocampo Wikizionario contiene il lemma di dizionario «ippocampo»
Wikizionario contiene il lemma di dizionario «ippocampo» Wikimedia Commons contiene immagini o altri file sull'ippocampo
Wikimedia Commons contiene immagini o altri file sull'ippocampo
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Michael A. Yassa, hippocampus, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Article in New Scientist, su newscientist.com.
- Scientific webpage of the project, su bmsr.usc.edu. URL consultato il 19 aprile 2008 (archiviato dall'url originale il 31 luglio 2007).
- Diagram of network (GIF), su bris.ac.uk. URL consultato il 19 aprile 2008 (archiviato dall'url originale il 16 maggio 2006).
- International Symposium “HIPPOCAMPUS AND MEMORY”, su hippo2006.psn.ru. URL consultato il 18 aprile 2019 (archiviato dall'url originale il 26 dicembre 2005).
- Diagram of a Hippocampal Brain Slice, su stanford.edu.
- Temporal-lobe.com An interactive diagram of the rat parahippocampal-hippocampal region, su temporal-lobe.com.
| Controllo di autorità | Thesaurus BNCF 51458 · LCCN (EN) sh85060982 · GND (DE) 4642127-0 · BNF (FR) cb11983242q (data) · J9U (EN, HE) 987007560445205171 |
|---|